В связи с пандемией Covid-2019 государственные медицинские и противоэпидемические службы России и большинства стран мира предпринимают беспрецедентные меры по профилактике и ликвидации данной угрозы. [1,2,3].
Основными путями передачи нового коронавируса SARS–CoV-2 являются воздушно-капельный (кашель и чихание) и контактный (через прикосновения). Коронавирус сохраняется в воздухе виде аэрозоля на протяжении 8—10 часов, на бумаге 3 часа, на банкнотах 4 дня, на дереве и одежде 2 дня, на стекле 4 дня, на металле и пластике 7 дней. [4]. Поэтому обязательному обеззараживанию должны подвергаться не только воздух, но и поверхности объектов в помещении [5,6].
Наименее трудоёмкими и универсальными методами, позволяющими одновременно обеззараживать воздух и поверхности помещении, являются аэрозольная обработка химическими дезинфектантами и облучение бактерицидным ультрафиолетовым излучением. Широкое использование аэрозольной дезинфекции ограничивается высокой токсичностью применяемых химических дезинфектантов и длительным временем (до 3-4 часов) воздействия, основная часть которого затрачивается на их нейтрализацию для безопасной эксплуатации помещений.
При разработке конкретной бактерицидной установки на основе ультрафиолетовой технологии требуется знание ее энергетических доз, которые необходимы для доказательства ее эффективности в отношении определённого микроорганизма или вируса [7].
В дальнейшем они необходимы для разработки оптимальных режимов обеззараживания их в воздухе и/или на открытых поверхностях. Режимы, сочетающие высокую степень инактивации конкретных микроорганизмов и вирусов (99,99 – 100%) за минимальное время обработки, смогут обеспечить высокую надёжность дезинфекционных мероприятий.
В России и за рубежом в клиническую практику активно внедряется в качестве наиболее эффективного, оперативного и наименее трудоёмкого метода ультрафиолетовая технология, использующая высокоинтенсивное ультрафиолетовое излучение сплошного спектра. Созданные на ее основе импульсные установки с ксеноновыми лампами, предназначенные для обеззараживания воздуха и открытых поверхностей помещений, демонстрируют высокую эффективность в отношении самых устойчивых микроорганизмов (MRSA,VRE, C.difficile, МЛУ-, ШЛУ-ТБ) и вирусов (полиомиелита, гриппа А, гепатита С, аденовируса) за минимальный промежуток времени (от 1 мин.) [8,9,10].
Исследования возможности высокоэффективного обеззараживания поверхностей, контаминированных коронавирусом SARS–СoV-2 с помощью ультрафиолетового излучения сплошного спектра и определение бактерицидных доз для получения требуемого эффекта является актуальной задачей, позволяющей грамотно разработать методы и регламенты обеззараживания помещений импульсными бактерицидными установками.
Материалы и методы
Экспериментальные исследования проводились на базе ФГБУ «48 Центральный научно-исследовательский институт» Минобороны России.
Исследования проводились с учетом основных требований Санитарно-эпидемиологических правил СП 1.3.3118-13 «Безопасность работы с микроорганизмами I-II групп патогенности (опасности)», Руководства Р 3.5.1904-04 «Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях», Методическими указаниями МУ 3.5.2431-08 «Изучение и оценка вирулицидной активности дезинфицирующих средств», 2010., а также по общепринятым методикам, разработанным в ЦНИИ» Минобороны России.
Оборудование
В качестве источников импульсного ультрафиолетового излучения сплошного спектра в экспериментах использовались импульсные ксеноновые лампы, работающие в составе передвижной импульсной УФ-установки «Альфа-06» и переносной импульсной УФ-установки «Альфа-09». Установки генерируют импульсы света с частотами 2,5 и 3,3 Гц. Средняя электрическая мощность ксеноновой лампы установки «Альфа-06» составляла 1000 Вт, установки «Альфа-09» - 200 Вт. Соответственно, пиковая мощность вспышки ультрафиолетового излучения достигала значения 900 кВт и 170 кВт во всем диапазоне УФ-излучения.
Тест-объекты
В качестве тест-объектов использовались металлические поверхности размером (5×5) см из нержавеющей стали марки 12Х18Н10Т, равномерно контаминированные штаммами коронавируса. Тест-объекты располагали в вертикальном положении на высоте 1м от пола и расстоянии: для установки «Альфа-06» - 2,0 м; для установки «Альфа-09» - 1,5 м.
Тест-вирус
В исследованиях использовалась живая культура вируса SARS-CoV-2 (изолят В от 16.03.2020 г) с исходной биологической активностью 5,8∙106 БОЕ∙мл-1.
Определение биологической концентрации коронавируса (биологической активности, уровней контаминации) проводили на флаконах с монослоем суточного возраста клеток Vero С1008 (площадью 25 см2) методом негативных колоний под агаровым покрытием. Биологическую активность рассчитывали по формуле 1:

где: А – биологическая активность (БОЕ∙мл-1); аср – среднее взвешенное число негативных колоний на флакон, рассчитывали по формуле (2), (БОЕ); bn – степень наивысшего разведения; с - объем инокулята (мл).
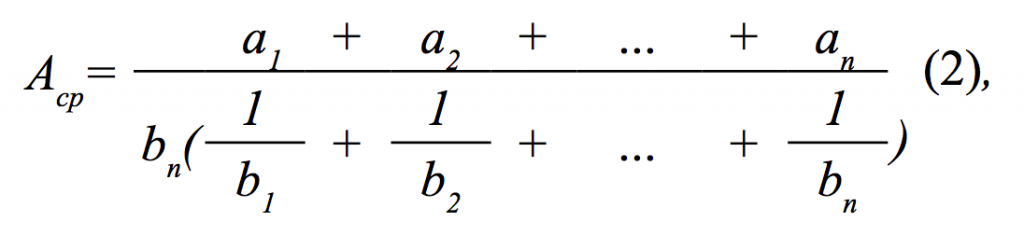
где: а1-аn – среднее число негативных колоний с 1-го по n-е разведение исследуемого материала; b1-bn – степень разведения исследуемого материала.
Уровни контаминации поверхности тест-объектов, соответственно инициальную и вторичную контаминации, рассчитывали по формуле (3):

где: АS – уровень контаминации, (БОЕ∙см-2); V – объем сорбирующей жидкости, используемой для смыва биологического материала с поверхности, (мл); S – площадь контаминации тест-объекта, (см2).
Статистическую обработку полученных данных проводили на основании вычисления среднего квадратичного отклонения по результатам пяти экспериментов.
Персонал, проводящий исследования с микроорганизмами I-II групп патогенности, был обеспечен рабочей и защитной одеждой, средствами индивидуальной защиты и средствами личной гигиены по регламентированным нормам. Испытания осуществлялись в «заразной» зоне по условиям максимально изолированной лаборатории.
Порядок проведения испытаний
Испытания проводили в рабочем помещении «заразной» зоны при температуре воздуха (24±1)оС и относительной влажности (42±3) %.
Установки располагались следующим порядком:
- Установку «Альфа-06» располагали боком, к размещённым вертикально на высоте 1,0 м тест-объектам, на расстоянии 2,0 м от них (Рисунок 1).

- Установку «Альфа-09» располагали боком, к размещённым вертикально на высоте 1,0 м тест-объектам, на расстоянии 1,5 м от них (Рисунок 2).

Испытания установок проводились в штатных режимах работы: «Бактерицидный», «Спороцидный», «Туберкулоцидный и фунгицидный», предназначенных для обеззараживания поверхностей (Таблица 1).

Первоначально готовили монослой суточного возраста культуры клеток Vero во флаконах. Для этого из флаконов с монослоем клеток, отобранных для опыта, после термостатирования сливали ростовую среду и маркировали их. На тест-объекты наносили по 0,1 мл исходной культуры вируса с биологической активностью 1,0∙106 БОЕ∙мл-1. Этот объем равномерно распределяли по всей поверхности тест-объекта стеклянным шпателем. Тест-объекты распределялись на контрольные и опытные. Контрольными служили тест-объекты на момент нанесения коронавируса, опытными – после их облучения с различной экспозицией с помощью импульсных УФ установок. На каждом режиме облучалось по 5 тест-объектов.
Пробы с тест-объектов до и после облучения отбирали методом смыва двумя марлевыми тампонами (увлажненным и сухим). Каждая проба подвергалась ручному встряхиванию в течение 3 мин в 10 мл сорбирующей жидкости.
Для определения в пробах биологической активности коронавируса в каждый флакон с монослоем вносили по 0,5 мл соответствующего разведения сорбирующей жидкости и покачивая флакон, равномерно распределяли инокулят по всему монослою. Флаконы укладывали горизонтально, при этом поверхность с инфицированным клеточным монослоем находилась внизу. Флаконы инкубировали в термостате при температуре (37,0оС ±0,5) в течение 60 мин. После инкубирования инокулят удаляли пипеткой и в каждый флакон вносили по 10 мл первичного агарового покрытия, доведенного до температуры (42,0оС. ±0,5). Далее флаконы укладывали горизонтально, при этом поверхность с инфицированным монослоем находилась внизу. После затвердевания покрытия (10-15 мин) флаконы переворачивали монослоем вверх и помещали в термостат с температурой (37,0оС ±0,5) на 48 часов. По истечении срока инкубации с целью окрашивания монослоя культуры клеток во флаконы вносили вторичное агаровое покрытие, содержащее нейтральный красный, в объеме 10 мл и продолжали инкубировать при температуре (37,0оС ±0,5) в течении 24 часов. После чего подсчитывали количество негативных колоний. Испытания сопровождались постановкой следующих контролей: контроль исходной биологической активности коронавируса; контроль разводящей (сорбирующей) жидкости, контроль культуры клеток Vero 1008.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Результаты определения уровней исходной и остаточной контаминации тест-объектов, контаминированных коронавирусом, а также эффективность их обеззараживания установкой «Альфа-06» для режимов № 1-3 представлены в таблице 2.3

Результаты определения уровней исходной и остаточной контаминации тест-объектов, контаминированных коронавирусом, а также эффективность их дезинфекции установкой «Альфа-09» для режимов № 4-6 представлены в таблице 3.

Полученные результаты экспериментов позволяют констатировать, что импульсное ультрафиолетовое излучение сплошного спектра, генерируемое установками «Альфа-06» и «Альфа-09» обладает высокой вирулицидной активностью в отношении короновируса SARS-CoV-2, вплоть до полной его инактивации (100%).
Проведенные испытания импульсных установок показали, что эффективность обработки поверхности установками:
- «Альфа-06» при использовании режима «Бактерицидный» составляет 99,98 % за 2 мин. воздействия, режимов «Спороцидный» и «Туберкулоцидный и фунгицидный» -100% за 3 мин. и 6 мин.30 сек. соответственно;
- «Альфа-09» при использовании режима «Бактерицидный» составляет 99.99% за 3 мин. 39 сек. воздействия, режимов «Спороцидный» и «Туберкулоцидный и фунгицидный» - 100%) за 6 мин. 45 сек. и 14 мин. 3 сек. соответственно.
Полученные результаты позволяют определить летальные поверхностные бактерицидные дозы импульсного ультрафиолетового излучения сплошного спектра, требуемые для полного обезвреживания поверхностей от SARS-CoV-2. Так для достижения 100% его инактивации на металлической поверхности требуются бактерицидные дозы (в спектральном интервале 200 – 300 нм) до 30 мДж/см2, а оценка пороговых доз (90% эффективность) даёт значения, не превышающие D90 = 4 мДж/см2. Эти данные позволяют разработать режимы работы импульсных установок и порядок обработки помещений с позиций доказательной медицины.
Полученные результаты позволяют рекомендовать использовать импульсные ультрафиолетовые установки «Альфа-06» и «Альфа-09» для обеззараживания помещений при проведении в них противоэпидемических мероприятий, связанных с высоким риском заноса и дальнейшего распространения возбудителя коронавирусной инфекции.
Список литературы
- Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)». Версия МЗ РФ и Роспотребнадзора 1 (29.01.2020).
- European Centre for Disease Prevention and Control (ECDC). Guidance for wearing and removing personal protective equipment in healthcare settings for the care of patients with suspected or confirmed COVID-19. Stockholm: ECDC; 2020.
- Профилактика заноса и распространения COVID-19 в медицинских организациях. Временные методические рекомендации. Версия 2 от 14.05.2020. // Брико Н.И., Зуева Л.П., и соавторы. – 2020. – 46 с.
- Alex Chin, Julie Chu, Mahen Perera, Kenrie Hui, Hui-Ling Yen. Stability of SARS-CoV-2 in different environmental conditions // medRxiv. 2020-03-27).
- Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность. СанПиН 2.1.3.2630-10, 2016.
- Об инструкции по проведению дезинфекционных мероприятий для профилактики заболеваний, вызываемых коронавирусами. Письмо Роспотребнадзора № 02/770-2020- 32 от 23.01.2020.
- Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях. Руководство Р 3 51904—04. М: Федеральный центр госсанэпиднадзора Минздрава России, 2005,46 с.
- Н. В. Шестопалов, В. Г. Акимкин и соавторы. «Исследование бактерицидной эффективности обеззараживания воздуха и открытых поверхностей импульсным ультрафиолетовым излучением сплошного спектра,» Медицинский алфавит. Эпидемиология и гигиена, т. 2, № 18, pp. 5-8, 2017.
- Stibich M., Stachowiak J., Tanner B., Berkheiser M., Moore L., Raad I., Chemaly R.F., «Evaluation of a pulsed-xenon ultraviolet room disinfection device for impact on hospital operations and microbial reduction,» Infection Control & Hospital Epidemiology, т. 32, № 3, pp. 286-288, Mar 2011.
- Priya Sampathkumar, Carla Folkert, Jean E. Barth and other, «A trial of pulsed xenon ultraviolet disinfection to reduce Clostridioides difficile infection» American Journal of Infection Control, т. 47, pp. 406-408, 2019.
Для цитирования
Зверев А. Ю., Борисевич С. В., Чепуренков Н. Я., Масякин Д. Н., Ковальчук Е. А., Быков В. А., Труфанова В. В., Тутельян А. В., Тиванова Е. В., Квасова О. А., Акимкин В. Г. Вирулицидная активность импульсного ультрафиолетового излучения сплошного спектра в отношении коронавируса SARS-CoV2. Медицинский алфавит. 2020; (18): 55–58. https://www.med-alphabet.com/jour/article/view/1639.
Читайте также по теме: Разработка и внедрение импульсных плазменно-оптических технологий и установок в космическую медицину и практическое здравоохранение