
В. И. ЛИТВИНОВ1, С. Г. САФОНОВА1, Г. Е. ФРЕЙМАН1, Е. П. СЕЛЬКОВА2, Т. А. ГРЕНКОВА2, М. П. ГУСАРОВА2
1- ГБУЗ «Московский научный центр борьбы с туберкулезом ДЗМ», Москва, Россия.
2- ФБУН «Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского Роспотребнадзора», Москва, Россия.
Представлены результаты экспериментальных исследований микобактерицидной активности импульсного ультрафиолетового излучения сплошного спектра в отношении лабораторного штамма Mycobacterium terrae и клинических штаммов Mycobacterium tuberculosis, обладающих множественной и широкой лекарственной устойчивостью. Источником ультрафиолетового излучения служила импульсная ксеноновая лампа передвижной установки «Альфа-01» для обеззараживания воздуха. Экспериментально показано, что импульсное УФ-излучение сплошного спектра обладает высокой активностью в отношении всех исследованных тест-штаммов и не зависит от расстояния до облучаемой поверхности (до 4 м). Эффективность обеззараживания контаминированных поверхностей достигала 100%. Воздействие излучением импульсных ксеноновых ламп на контаминированные объекты приводит к многочисленным молекулярно-генетическим изменениям макромолекулы ДНК в клетках с полной потерей лекарственной устойчивости к рифампицину и частично к изониазиду.
Комплекс дезинфекционных мероприятий (ДМ) в медицинских организациях является одним из основных методов профилактики инфекций, связанных с оказанием медицинской помощи. Практически для всех методов дезинфекции разработаны режимы, позволяющие с различной степенью эффективности обеззараживать воздух и поверхности объектов больничной среды от всех видов патогенной микрофлоры (бактерицидный, спороцидный, вирулицидный и фунгицидный) [8, 11].
Более детального рассмотрения требует такой вид бактерицидного режима, как туберкулоцидный. Применение средств и оборудования для дезинфекции с использованием данного режима является одним из основных методов профилактики туберкулеза. К нему предъявляются повышенные требования для исключения заноса микобактерий туберкулеза (МБТ) в помещения, их дальнейшей циркуляции внутри помещений, выноса за пределы помещений, а также при работе во внебольничных очагах туберкулеза [9]. Необходимость бактерицидного режима в отношении МБТ в инструкциях по эксплуатации/руководствах для средств дезинфекции обусловлена не только широким его применением в противотуберкулезных учреждениях, но и в медицинских учреждениях общего профиля в связи с нередкими случаями заноса в них МБТ при госпитализации больных туберкулезом с бактериовыделением [9]. МБТ, включая их госпитальные штаммы, обладающие множественной и широкой устойчивостью к антимикробным препаратам, имеют более высокий ранг устойчивости (D) к средствам дезинфекции по сравнению с вегетативными формами бактерий (В) [11]. Возросла доля эпидемического распространения на большей части территории РФ штаммов M. tuberculosis генетического семейства Beijing, отличающихся высокой приспособляемостью к выживанию и высокой ассоциацией с лекарственной устойчивостью [10]. Большинство химических дезинфектантов, применяемых по туберкулоцидному режиму, требуют применения их высоких концентраций и увеличенного времени экспозиции, что сопровождается высокой токсикологической опасностью для пациентов, персонала и приводит к высокой трудоемкости и длительности проведения ДМ [8]. Препараты на основе четвертичных аммониевых соединений (наиболее применяемые в медицинских организациях), производных солей гуанидина не обладают выраженным туберкулоцидным эффектом [8]. Кроме того, на снижение эффективности метода протирки с применением растворов дезинфектантов значительно влияет так называемый человеческий фактор. Множество путей и факторов передачи туберкулезной инфекции (аэрогенный – аэрозольный, воздушно-пылевой, алиментарный и контактный) требует обеззараживания как воздуха, так и большого количества поверхностей объектов больничной среды. Это требует применения для всех методов дезинфекции туберкулоцидных режимов, отвечающих следующим критериям: - подтверждение эффективности при проведении лабораторных испытаний в аккредитованных центрах не только с использованием утвержденных музейных тест-микроорганизмов, но и клинических штаммов МБТ, включая штаммы, обладающие множественной и широкой лекарственной устойчивостью; - обеспечение обеззараживания воздуха помещений с эффективностью не менее 99,9% и поверхностей объектов больничной среды с эффективностью не менее 99,99%; - низкая трудоемкость и короткая длительность обработки помещений; - минимизация человеческого фактора, Наиболее эффективным и отвечающим вышеприведенным критериям методом обеззараживания помещений является физический метод на основе ультрафиолетового (УФ) облучения. Для повышения эффективности и сокращения времени обработки помещений в мировой практике применяют мощные (более 1,5 кВт) УФ-установки открытого типа [15]. В настоящее время в мировой медицинской практике активно внедряется принципиально новая дезинфекционная технология с использованием облучения помещений высокоинтенсивными потоками УФ-излучения сплошного спектра (200-800 нм), генерируемого импульсными ксеноновыми лампами [2, 4, 14], которая принципиально отличается по механизмам действия на живую материю от широко распространенного метода облучения помещений монохромным УФ-излучением ртутных или амальгамных ламп низкого давления. Многолетний опыт применения импульсных УФ-установок показал высокую эффективность обеззараживания воздуха и поверхностей помещений за короткое время обработки [12, 13, 16]. Цель исследования: изучение микобактерицидной активности импульсного УФ-излучения сплошного спектра в отношении Mycobacterium terraе.
Материалы и методы
На базе аккредитованного испытательного лабораторного центра ФБУН «Московский НИИ эпидемиологии и микробиологии им. Н. Г. Габричевского» Роспотребнадзора проведено экспериментальное исследование эффективности импульсного УФ-излучения сплошного спектра в отношении штаммов микобактерий Mycobacterium terraе DSM 43227 ATCC 15755. В качестве тест-микроорганизма использовали штамм Mycobacterium terrae DSM 43227 ATCC 15755, выпуск 06.2011 г., в виде суспензии, приготовленной по оптическому стандарту (109 КОЕ/мл), которым искусственно контаминировали тест-поверхности (пластиковые чашки Петри). Cуточную взвесь культуры Mycobacterium terrae готовили по отраслевым стандартным образцам мутности 1 × 109 на физиологическом растворе. Проводили контроль жизнеспособности культуры (не менее трех повторностей). Для получения взвеси 1 × 107 проводили два серийных разведения с контролем жизнеспособности культуры в трех повторностях [5]. При помощи микропипетки наносили 100 мкл микробной смеси на дно стерильной чашки Петри, растирали шпателем, подсушивали и располагали вертикально от лампы на расстоянии 2 и 4 м. Проводили облучение с временными экспозициями 2, 4, 8, 16 и 30 мин, затем добавляли 9,9 мл стерильного физиологического раствора, перемешивали круговыми движениями и делали 3 серийных разведения.
Из каждого разведения делали по три высева на косяки со средой Левенштейна ‒ Йенсена. Через 21 день инкубации при 37°С проводили подсчет выживших клеток (опыт) [5]. Контроль проводили аналогично опыту, но без облучения. Исследования выполняли в трех повторностях для каждого временного режима и расстояния от источника облучения до тест-поверхности. В качестве источника импульсного УФ-излучения сплошного спектра использовалась серийновыпускаемая передвижная «Установка импульсная ксеноновая УФ-бактерицидная для экстренной дезинфекции воздуха помещений 1 и 2 категории при отсутствии людей УИКб-01-«Альфа» (далее ‒ «Альфа-01»). Установка «Альфа-01» генерировала световые вспышки с частотой 2,5 Гц. Средняя электрическая мощность импульсной ксеноновой лампы составила 1 кВт. Микобактерицидную эффективность импульсного УФ-излучения (в %) в отношении Mycobacterium terrae определяли как отношение разности среднего значения числа микобактерий в контрольных чашках Петри и чашках Петри, подвергнутых облучению, к среднему значению числа микобактерий в контрольных чашках, умноженное на 100 [3]. Исследование микобактерицидной активности импульсного УФ-излучения сплошного спектра в отношении клинических штаммов Mycobacterium tuberculosis, обладающих множественной лекарственной устойчивостью Исследования проводили на базе Московского научно-практического центра по борьбе с туберкулезом ДЗМ. В экспериментах использовали десять свежевыделенных от больных туберкулезом штаммов M. tuberculosis, обладающих множественной лекарственной устойчивостью (одновременной устойчивостью к изониазиду и рифампицину). Лекарственная чувствительность тест-штаммов заранее определена с помощью метода абсолютных концентраций согласно приказу Минздрава РФ № 109 от 21 марта 2003 г. [7]. Исследуемые штаммы характеризуются высоким полиморфизмом (наличием колбообразных и ветвящихся форм), накопленных хромосомных мутаций и, как следствие, обладают высокой лекарственной устойчивостью и большей устойчивостью к внешним факторам среды по сравнению с чувствительными штаммами [1, 12]. Кроме того, исследования активности монохромного УФ-излучения ртутных ламп в отношении таких штаммов отсутствуют. Учитывая высокую патогенность штаммов, исследование проводили в ламинарном шкафу II степени биологической безопасности с помощью импульсной ксеноновой лампы с расстояния 28 см от поверхности чашки Петри с облучаемой микобактериальной суспензией в течение 5 мин. Стандартизацию дозы микобактерий производили по стандарту № 5 ГИСК = 500 000 000 микробных тел/мл стерильной дистиллированной воды с по следующими серийными разведениями до получения требуемой микробной нагрузки (250 КОЕ/мл). Полученную суспензию каждого испытуемого штамма M. tuberculosis делили на 2 порции. Одна являлась контрольной и переносилась в пробирку с жидкой полусинтетической средой Школьниковой с 10%-ной инактивированной сывороткой крупного рогатого скота и во избежание воздействия импульсного УФ-излучения сразу же переносили в другое помещение (контроль). Вторая порция выливалась в стерильную чашку Петри и подвергалась воздействию импульсного УФ-излучения. По окончании опыта облученную суспензию переносили в соседнее помещение и немедленно заливали на пробирку с жидкой полусинтетической средой Школьниковой с 10%-ной инактивированной сывороткой крупного рогатого скота (опыт). Каждый исследуемый штамм облучался отдельно в пяти повторениях. По завершении опытов облученные и контрольные пробирки помещали в термокамеру для инкубации. Учет результатов проводили микроскопически и макроскопически по истечении оптимальных сроков культивирования и при появлении видимого ad oculus роста микобактерий в контрольных и опытных пробирках. Кроме того, для уточнения механизмов инактивации проведены исследования молекулярно-генетических изменений ДНК в клетках тех же 10 штаммов, подвергнутых импульсному УФ-облучению. После импульсного УФ-облучения из клеток МБТ выделяли ДНК. Определение нарушений в ДНК МБТ проводили с помощью биологических микрочипов «ТБ-БИОЧИП (МЛУ)», разработанных в ИМБ им. В. А. Энгельгардта РАН. Результат регистрировали с помощью портативного анализатора биочипов «БИОЧИП-ИМБ» с соответствующим программным обеспечением. Изучали наличие или отсутствие мутаций, определяющих резистентность к рифампицину в гене RроВ (507-533 кодоны), ответственном за синтез β-субъединицы РНК-полимеразы, и генов, ответственных за резистентность к изониазиду: каtG (с 315 по 335 кодоны), отвечающего за синтез фермента каталаза-пероксидаза; гена inhA (промоторная и структурная области), отвечающего за метаболизм фермента енол-АСР-редуктаза, аhрС (промоторная область), отвечающего за метаболизм фермента алкил-гидропероксид-редуктаза. Исследования микобактерицидной активности импульсного УФ-излучения сплошного спектра в отношении микобактерий туберкулеза, обладающих широкой лекарственной устойчивостью (ШЛУ МБТ) также проводили на базе Московского научно-практического центра по борьбе с туберкулезом ДЗМ. В опытах использовали контрольные тест-штаммы (Mycobacterium terrae (коллекция МНИИ эпидемиологии и микробиологии им. Г. Н. Габричевского), Mycobacterium tuberculosis H37RV), а также 10 клинических штаммов Mycobacterium tuberculosis, обладающих широкой лекарственной устойчивостью (к изониазиду, рифампицину, аминогликозидам, этамбутолу, пиразинамиду, капреомицину, этионамиду и фторхинолонам). Лекарственная чувствительность тест-штаммов была заранее определена с помощью метода абсолютных концентраций согласно приказу Минздрава РФ № 109 от 21 марта 2003 г. [7]. Стандартизацию дозы микобактерий производили по стандарту № 5 ГИСК = 500 000 000 микробных тел/мл стерильной дистиллированной воды с последующими серийными разведениями до получения требуемой микробной нагрузки (250 КОЕ/мл). Полученные суспензии делили так же, как в исследовании с МЛУ-штаммами M. tuberculosis, на 2 порции (опыт и контроль). Микробная суспензия в контрольной группе (первая порция) засевалась без облучения. Вторая порция (опыт) облучалась импульсным УФ-излучением в ламинарном шкафу II степени биологической безопасности с расстояния 40 см от импульсной ксеноновой лампы при различных экспозициях (20 с, 1 мин, 3 мин) и в дальнейшем после облучения засевалась на жидкие и плотные среды. По завершении посевов опытные и контрольные пробирки и чашки Петри помещали в термальную камеру для инкубации и в автоматизированный прибор Bactec MGIT 960 для инкубации. Учет результатов проводили микроскопически и макроскопически по истечении максимальных сроков культивирования (аналогично исследованию с МЛУ-штаммами M. tuberculosis) и датам регистрации прибора Bactec MGIT 960. В случае роста микобактерий в опытной группе повторно проводили определение лекарственной чувствительности M. tuberculosis, выросших после облучения. Микобактерицидную эффективность в отношении МЛУ- и ШЛУ-штаммов определяли по отсутствию (- отсутствие роста) или наличию роста (+ наличие роста) КОЕ МБ. Степень контаминации тест-объектов выражали следующим образом: + наличие роста МБ (1-20 КОЕ), ++- - умеренный рост МБ (21-100 КОЕ); +++ - обильный рост МБ (> 100 КОЕ).
Результаты исследования
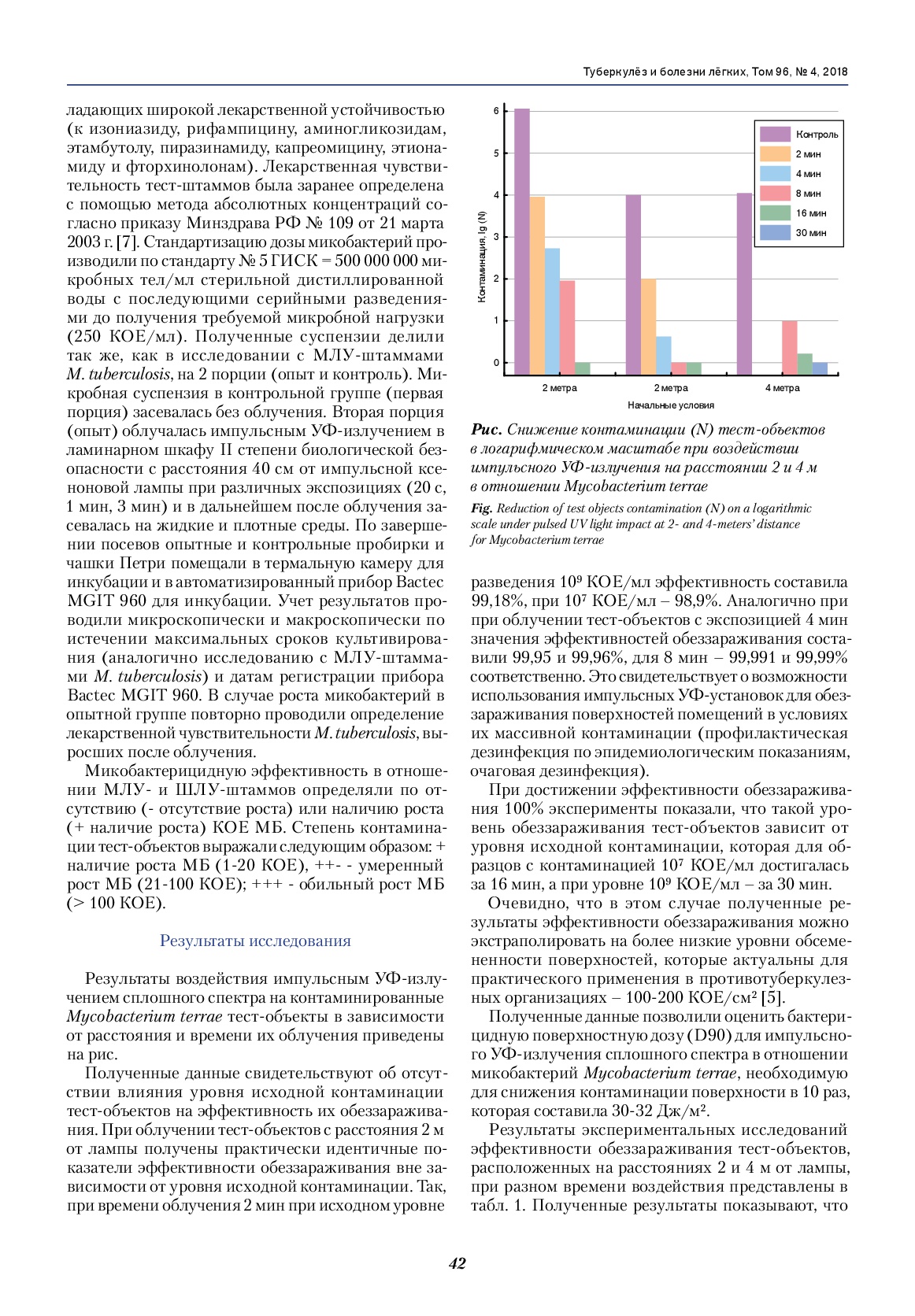
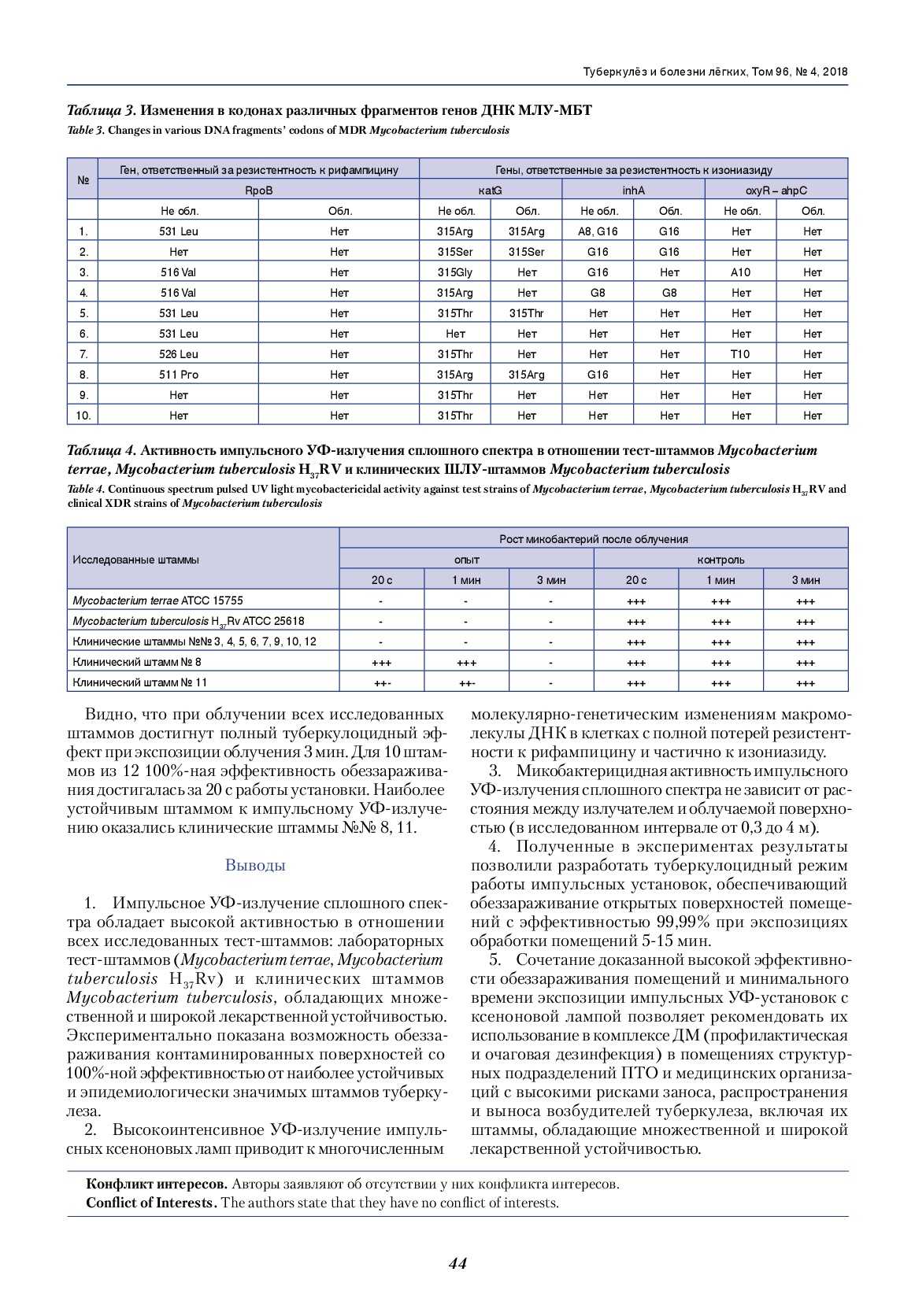
Результаты воздействия импульсным УФ-излучением сплошного спектра на контаминированные Mycobacterium terraе тест-объекты в зависимости от расстояния и времени их облучения приведены на рис. Полученные данные свидетельствуют об отсутствии влияния уровня исходной контаминации тест-объектов на эффективность их обеззараживания. При облучении тест-объектов с расстояния 2 м от лампы получены практически идентичные показатели эффективности обеззараживания вне зависимости от уровня исходной контаминации. Так, при времени облучения 2 мин при исходном уровне разведения 109 КОЕ/мл эффективность составила 99,18%, при 107 КОЕ/мл – 98,9%. Аналогично при облучении тест-объектов с экспозицией 4 мин значения эффективностей обеззараживания составили 99,95 и 99,96%, для 8 мин – 99,991 и 99,99% соответственно.
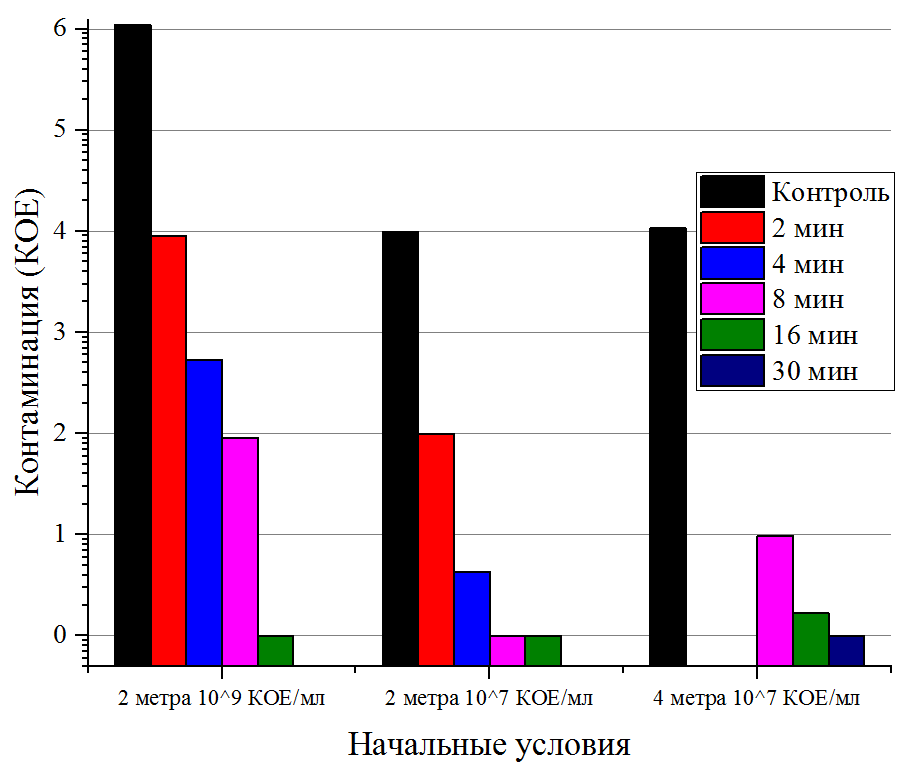
Рис. Снижение контаминации (N) тест-объектов в логарифмическом масштабе при воздействии импульсного УФ-излучения на расстоянии 2 и 4 м в отношении Mycobacterium terraе.
Fig. Reduction of test objects contamination (N) on a logarithmic scale under pulsed UV light impact at 2- and 4-meters’ distance for Mycobacterium terrae.
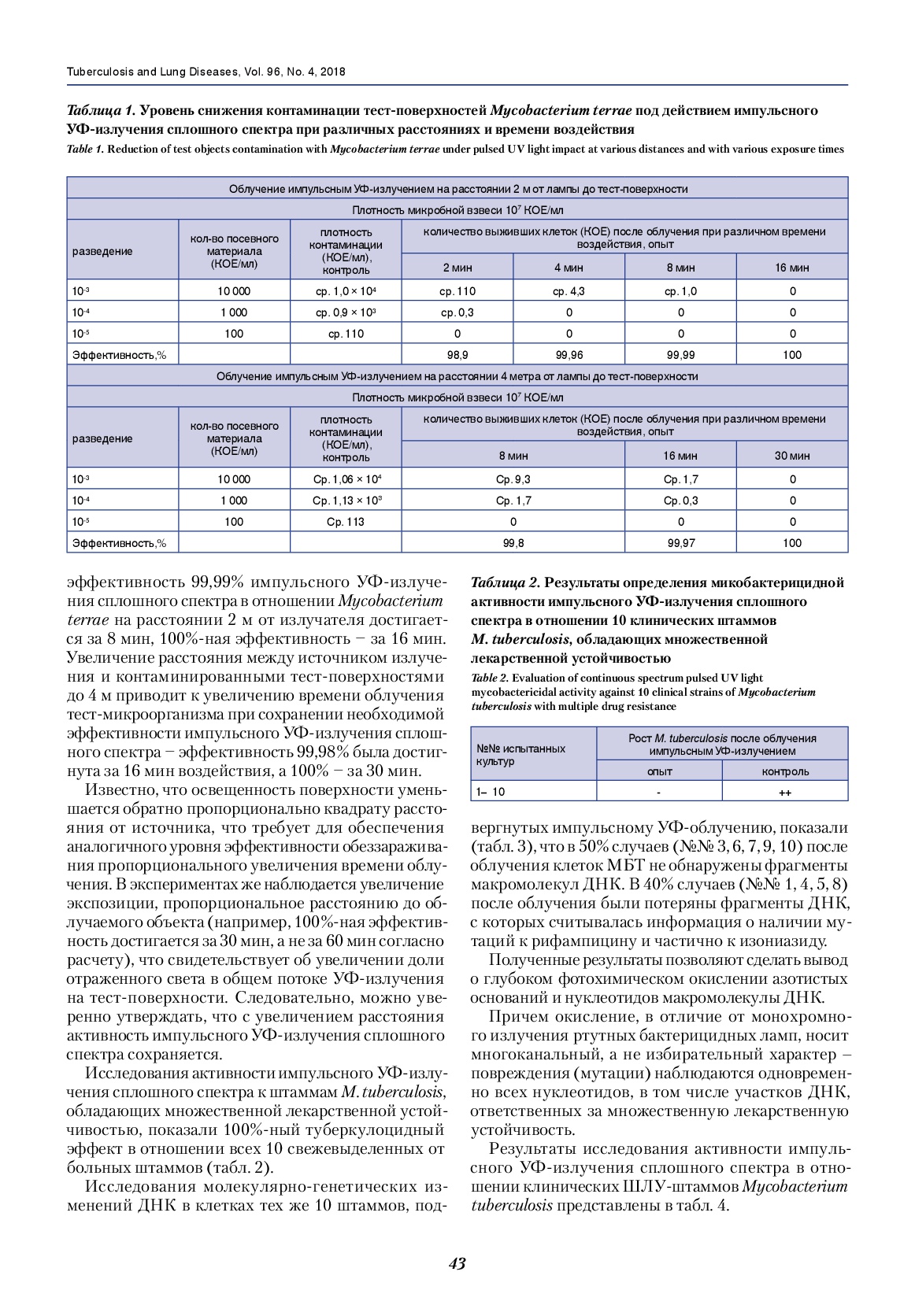
Это свидетельствует о возможности использования импульсных УФ-установок для обеззараживания поверхностей помещений в условиях их массивной контаминации (профилактическая дезинфекция по эпидемиологическим показаниям, очаговая дезинфекция). При достижении эффективности обеззараживания 100% эксперименты показали, что такой уровень обеззараживания тест-объектов зависит от уровня исходной контаминации, которая для образцов с контаминацией 107 КОЕ/мл достигалась за 16 мин, а при уровне 109 КОЕ/мл – за 30 мин. Очевидно, что в этом случае полученные результаты эффективности обеззараживания можно экстраполировать на более низкие уровни обсемененности поверхностей, которые актуальны для практического применения в противотуберкулезных организациях – 100-200 КОЕ/см2 [5]. Полученные данные позволили оценить бактерицидную поверхностную дозу (D90) для импульсного УФ-излучения сплошного спектра в отношении микобактерий Mycobacterium terraе, необходимую для снижения контаминации поверхности в 10 раз, которая составила 30-32 Дж/м2. Результаты экспериментальных исследований эффективности обеззараживания тест-объектов, расположенных на расстояниях 2 и 4 м от лампы, при разном времени воздействия представлены в табл. 1.
Таблица 1. Уровень снижения контаминации тест-поверхностей Mycobacterium terrae под действием импульсного УФ-излучения сплошного спектра при различных расстояниях и времени воздействия.
Table 1. Reduction of test objects contamination with Mycobacterium terrae under pulsed UV light impact at various distances and with various exposure times.
Полученные результаты показывают, что эффективность 99,99% импульсного УФ-излучения сплошного спектра в отношении Mycobacterium terraе на расстоянии 2 м от излучателя достигается за 8 мин, 100%-ная эффективность ‒ за 16 мин. Увеличение расстояния между источником излучения и контаминированными тест-поверхностями до 4 м приводит к увеличению времени облучения тест-микроорганизма при сохранении необходимой эффективности импульсного УФ-излучения сплошного спектра ‒ эффективность 99,98% была достигнута за 16 мин воздействия, а 100% ‒ за 30 мин. Известно, что освещенность поверхности уменьшается обратно пропорционально квадрату расстояния от источника, что требует для обеспечения аналогичного уровня эффективности обеззараживания пропорционального увеличения времени облучения. В экспериментах же наблюдается увеличение экспозиции, пропорциональное расстоянию до облучаемого объекта (например, 100%-ная эффективность достигается за 30 мин, а не за 60 мин согласно расчету), что свидетельствует об увеличении доли отраженного света в общем потоке УФ-излучения на тест-поверхности. Следовательно, можно уверенно утверждать, что с увеличением расстояния активность импульсного УФ-излучения сплошного спектра сохраняется. Исследования активности импульсного УФ-излучения сплошного спектра к штаммам M. tuberculosis, обладающих множественной лекарственной устойчивостью, показали 100%-ный туберкулоцидный эффект в отношении всех 10 свежевыделенных от больных штаммов (табл. 2).
Таблица 2. Результаты определения микобактерицидной активности импульсного УФ-излучения сплошного спектра в отношении 10 клинических штаммов M. tuberculosis, обладающих множественной лекарственной устойчивостью.
Table 2. Evaluation of continuous spectrum pulsed UV light mycobactericidal activity against 10 clinical strains of Mycobacterium tuberculosis with multiple drug resistance.
Исследования молекулярно-генетических изменений ДНК в клетках тех же 10 штаммов, подвергнутых импульсному УФ-облучению, показали (табл. 3),
Таблица 3. Изменения в кодонах различных фрагментов генов ДНК МЛУ-МБТ.
Table 3. Changes in various DNA fragments’ codons of MDR Mycobacterium tuberculosis.
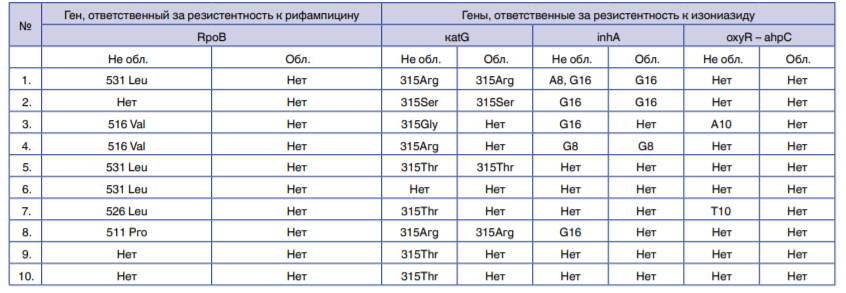
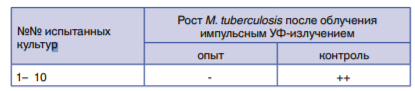
что в 50% случаев (№№ 3, 6, 7, 9, 10) после облучения клеток МБТ не обнаружены фрагменты макромолекул ДНК. В 40% случаев (№№ 1, 4, 5, 8) после облучения были потеряны фрагменты ДНК, с которых считывалась информация о наличии мутаций к рифампицину и частично к изониазиду. Полученные результаты позволяют сделать вывод о глубоком фотохимическом окислении азотистых оснований и нуклеотидов макромолекулы ДНК. Причем окисление, в отличие от монохромного излучения ртутных бактерицидных ламп, носит многоканальный, а не избирательный характер – повреждения (мутации) наблюдаются одновременно всех нуклеотидов, в том числе участков ДНК, ответственных за множественную лекарственную устойчивость. Результаты исследования активности импульсного УФ-излучения сплошного спектра в отношении клинических ШЛУ-штаммов Mycobacterium tuberculosis представлены в табл. 4.
Таблица 4. Активность импульсного УФ-излучения сплошного спектра в отношении тест-штаммов Mycobacterium terrae, Mycobacterium tuberculosis H37RV и клинических ШЛУ-штаммов Mycobacterium tuberculosis.
Table 4. Continuous spectrum pulsed UV light mycobactericidal activity against test strains of Mycobacterium terrae, Mycobacterium tuberculosis H37RV and clinical XDR strains of Mycobacterium tuberculosis.
Видно, что при облучении всех исследованных штаммов достигнут полный туберкулоцидный эффект при экспозиции облучения 3 мин. Для 10 штаммов из 12 100%-ная эффективность обеззараживания достигалась за 20 с работы установки. Наиболее устойчивым штаммом к импульсному УФ-излучению оказались клинические штаммы №№ 8, 11.
Выводы
- Импульсное УФ-излучение сплошного спектра обладает высокой активностью в отношении всех исследованных тест-штаммов: лабораторных тест-штаммов (Mycobacterium terrae, Мycobacterium tuberculosis H37Rv) и клинических штаммов Mycobacterium tuberculosis, обладающих множественной и широкой лекарственной устойчивостью. Экспериментально показана возможность обеззараживания контаминированных поверхностей со 100%-ной эффективностью от наиболее устойчивых и эпидемиологически значимых штаммов туберкулеза.
- Высокоинтенсивное УФ-излучение импульсных ксеноновых ламп приводит к многочисленным молекулярно-генетическим изменениям макромолекулы ДНК в клетках с полной потерей резистентности к рифампицину и частично к изониазиду.
- Микобактерицидная активность импульсного УФ-излучения сплошного спектра не зависит от расстояния между излучателем и облучаемой поверхностью (в исследованном интервале от 0,3 до 4 м).
- Полученные в экспериментах результаты позволили разработать туберкулоцидный режим работы импульсных установок, обеспечивающий обеззараживание открытых поверхностей помещений с эффективностью 99,99% при экспозициях обработки помещений 5-15 мин.
- Сочетание доказанной высокой эффективности обеззараживания помещений и минимального времени экспозиции импульсных УФ-установок с ксеноновой лампой позволяет рекомендовать их использование в комплексе ДМ (профилактическая и очаговая дезинфекция) в помещениях структурных подразделений ПТО и медицинских организаций с высокими рисками заноса, распространения и выноса возбудителей туберкулеза, включая их штаммы, обладающие множественной и широкой лекарственной устойчивостью.
ЛИТЕРАТУРА
- Вишневский Б. И. Лекарственная устойчивость микобактерий туберкулеза. Лекция // Медицинский альянс. – 2017. ‒ № 1. ‒ С. 29-35.
- Гольдштейн Я. А., Голубцов А. А., Шашковский С. Г. Обеззараживание воздуха и открытых поверхностей помещений импульсным ультрафиолетовым излучением в медицинских организациях // Поликлиника. – 2014. ‒ № 3 (2). ‒ С. 51-54.
- Использование ультрафиолетового излучения для обеззараживания воздуха в помещениях. Руководство Р 3.5.1904-04. ‒ М.: Федеральный центр госсанэпиднадзора Минздрава России, 2005. ‒ 46 с.
- Камруков А. С., Козлов Н. П., Ушаков И. Б., Шашковский С. Г. Разработка и внедрение импульсных плазменно-оптических технологий и установок в космическую медицину и практическое здравоохранение // Газета «Вестник МГТУ им. Н. Э. Баумана». ‒ 2011. ‒ С. 107-119.
- Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств. Методические указания МУ 3.5.2596-10 // Федеральный центр гигиены и эпидемиологии Роспотребнадзора. – М., 2010. – 54 с.
- Мордовской Г. Г., Поникаровская И. В., Якушкина А. Ю., Путырский В. П., Ямпольский В. А., Панов Г. В. Методы выделения микобактерий туберкулеза при санитарно-бактериологической оценке загрязненности воздуха и поверхностей противотуберкулезных учреждений // Вестник Уральской медицинской академической науки. ‒ 2015. ‒ № 2 (53) ‒ С. 16-18.
- Приказ Минздрава РФ от 21.03.2003 г. № 109 «O cовершенствовании противотуберкулезных мероприятий в Российской Федерации»
- Р 4.2.2643-10. 3.5. Дезинфектология. Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности. Руководство // Федеральный центр гигиены и эпидемиологии Роспотребнадзора. – М., 2010. – 615 с.
- Система инфекционного контроля в противотуберкулезных учреждениях. Руководство / Под ред. Л. С. Федоровой. ‒ М. – Тверь: ООО «Издательство «Триада», 2013. ‒ 192 с.
- Ситуация по туберкулезу в 2016 г. // Аналитические обзоры по туберкулезу. Центр мониторинга туберкулеза. ФГБУ «Центральный НИИ организации и информатизации здравоохранения. https://mednet.ru/index.php?Itemid=137 – М., 2016. – 69 с.
- Шестопалов Н. В., Пантелеева Л. Г., Соколова Н. Ф., Абрамова И. М., Лукичев С. П. Федеральные клинические рекомендации по выбору химических средств дезинфекции и стерилизации для использования в медицинских организациях. ‒ М., 2015 г. – 67 с.
- Chan-Ick Cheigh, Mi-Hyun Park, Myong-Soo Chung, Jung-Kue Shin, Young-Seo Park. Comparison of intense pulsed light- and ultraviolet (UVC)-induced cell damage in Listeria monocytogenes and Escherichia coli O157:H7 // Food Control 25. ‒ 2012. ‒ P. 654-659.
- Guillou S., Leroi F., Orange N., Bakhrouf A., Federighi M., Elmnasser N. Pulsed-light system as a novel food decontamination technology: a review // Canad. J. Microbiology. ‒ 2007. ‒ Vol. 53, № 7. ‒ P. 813-821.
- http://www.thecleanzine.com/hospital_hygiene.php
- https://www.melitta-uv.ru, https://www.xenex.com
- Ren Zhuo Chen, Stephen A. Craik, James R. Bolton Comparison of the action spectra and relative DNA absorbance spectra of microorganisms: Information important for the determination of germicidal fluence (UV dose) in an ultraviolet disinfection of water // Water research. ‒ 2009. ‒ Vol. 43. ‒ P. 5087-5096.
Литвинов В.И., Сафонова С.Г., Фрейман Г.Е., ГБУЗ "Московский научный центр борьбы с туберкулезом ДЗМ", Селькова Е.П., Гренкова Т.А., Гусарова М.П., ФБУН "Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н. Габричевского Роспотребнадзора", Исследование микобактерицидной активности импульсного ультрафиолетового излучения сплошного спектра , Научно-практический журнал "Туберкулез и болезни легких", том 96, № 4, 2018 г.