
Научная статья
А.В.Тутельян1, Е.А.Черкашин1, Е.А.Замотаева1, О.А.Абросимова1, А.О Потапенко2, Шашковский С.Г.2, Гольдштейн Я.А.2, Акимкин В.Г.1
- Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора, Россия,111123, г. Москва, ул. Новогиреевская, 3а
- ООО НПП «Мелитта», Россия, 117997, г. Москва, ул. Миклухо-Маклая, д. 16/10
Цель исследования. Оценка эффективности разрушения коротких ПЦР-ампликонов с помощью импульсного источника излучения широкого спектра.
Материалы и методы. С помощью источника импульсного УФ-излучения проведены эксперименты на ампликонах ДНК длиной 117 п. н. Эффективность деконтаминации оценивали по остаточному количеству ампликонов в смывах с рабочих поверхностей, таких как пластик, стекло и металл.
Результаты. Была показана высокая эффективность импульсного УФ-излучения в борьбе с контаминацией ДНК, определено оптимальное время облучения (10–12 мин), достаточное для полного разрушения ампликонов на различных типах поверхности (пластик, стекло, металл). Полученные данные позволяют сократить время обработки помещений и снизить негативное воздействие от УФ-излучения на лабораторное оборудование и помещения. Заключение. Продемонстрирована целесообразность использования импульсных установок, генерирующих высокоинтенсивные потоки УФ-излучения сплошного спектра, для разрушения ампликонов на различных поверхностях.
Полимеразная цепная реакция- это метод, имитирующий естественную репликацию ДНК и позволяющий обнаружить единственную специфическую молекулу ДНК в присутствии миллионов других молекул. Открытие метода полимеразной цепной реакции (ПЦР) стало одним из наиболее выдающихся событий в области молекулярной биологии за последние десятилетия. Это позволило поднять медицинскую диагностику на качественно новый уровень.
Основные принципы использования праймеров (коротких искусственно синтезированных молекул ДНК) и состав ингредиентов, входящих в реакционную смесь для получения копий ДНК впервые были описаны Kleppe с соавт. в 1971 году [1]. Однако тогда еще не была продемонстрирована основная черта ПЦР - экспоненциальное увеличение количества копий фрагмента исходной ДНК как результат реакции.
В 1983 году сотрудник фирмы "Cetus" Kary Mullis предложил метод, ставший в дальнейшем известным как полимеразная цепная реакция [2]. Суть метода заключается в многократном копировании (амплификации) в пробирке определенных участков ДНК в процессе повторяющихся температурных циклов. На каждом цикле амплификации синтезированные ранее фрагменты вновь копируются ДНК-полимеразой. Благодаря этому происходит многократное увеличение количества специфических фрагментов ДНК, что значительно упрощает дальнейший анализ.
Результатом открытия ПЦР стало почти немедленное практическое применение метода. Метод приобрел такую популярность, что сегодня уже трудно представить работу в области молекулярной биологии без его использования. Особенно бурное развитие метод полимеразной цепной реакции получил благодаря международной программе "Геном человека". Были созданы современные лазерные технологии секвенирования (расшифровки нуклеотидных последовательностей ДНК). Если в недавнем прошлом для расшифровки последовательности ДНК размером в 250 пар нуклеотидов (п.н.) требовалась неделя, то современные лазерные секвенаторы позволяют определять несколько тысяч п.н. за одни сутки [3]. Это, в свою очередь, способствует значительному росту лабораторий, применяющих в своих целях различные модификации ПЦР, от создания тест-систем для обнаружения микроорганизмов до выявления точечных (однонуклеотидных) мутаций в исследуемом гене. Уже описаны десятки различных применений метода в качестве главного метода детекции инфекционных заболеваний, позволяющего определять непосредственно возбудителя заболевания в очень низкой концентрации [4-6].
Высокая чувствительность полимеразной цепной реакции делает совершенно необходимым особенно тщательное устройство ПЦР-лаборатории и выдвигает на первый план проблему контаминации, т.е. попадание из внешней среды в реакционную смесь специфических и неспецифических молекул ДНК, способных служить мишенями в реакции амплификации и давать ложноположительные или ложноотрицательные результаты. Такими мишенями могут быть продукты реакции, попадающие во внешнюю среду на этапе детекции из пробирок, в которых успешно прошла амплификация, либо специфическая ДНК из образцов на этапе пробоподготовки [7].
Существует несколько способов борьбы с этим неприятным явлением. Одним из них является использование фотохимического воздействия на молекулы ДНК. Для этого используют псорален или изопсорален, которые активируются кратковременным облучением ультрафиолетовым светом. Модифицированные этими соединениями молекулы ДНК не могут участвовать в реакции амплификации [8].
Однако, как известно, ни одна биологическая или химическая реакция не идёт со 100% эффективностью и, соответственно, после инактивации продуктов амплификации из миллиардов копий амплифицированного фрагмента хотя бы несколько останутся целыми, что существенно снижает ценность такого подхода. Кроме того, всегда остается риск кросс-контаминации от образца к образцу в процессе пробоподготовки.
Таким образом, этот метод лишь в некоторой степени позволяет устранить источник контаминации и не гарантируют от ложноположительных и ложноотрицательных результатов.
Согласно тексту методических указаний «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности» при возникновении контаминации лаборатории проводят следующие мероприятия:
- поверхности каждого участка вначале обрабатывают моющим раствором для удаления жировых загрязнений, после чего остатки моющего средства удаляются ветошью, смоченной водой;
- на поверхность наносят на 30 мин. 0,2%-ный раствор ДП-2Т или аналогичные ему растворы, разрешенные к применению для этих целей в установленном порядке;
- после завершения указанной обработки проводят обеззараживание влажных поверхностей ультрафиолетовым излучением в течение 45 мин.;
- загрязненный расходный материал (пробирки, наконечники, реактивы и т.п.) и контаминированный рабочий исследуемый материал (кроме исходного материала) обеззараживают через автоклавирование.
Если все же, несмотря на принятые меры, обнаружены следы контаминации, то обработку повторяют. При этом проведение ПЦР-исследований до завершения деконтаминационных мероприятий не допускается [9].
При проведении деконтаминационных мероприятий используют свойство нуклеиновых кислот связываться с компонентами дезинфицирующих растворов и/или деградировать под действием интенсивного свободно-радикального окисления, в ходе которого происходит разрыв нитей ДНК. Аналогичным образом происходит процесс деградации нуклеиновых кислот в присутствии переходных металлов, благодаря их способности инициировать процесс образования свободных радикалов из устойчивых соединений. Однако дезинфицирующие средства на основе пероксидных соединений и хлора обладают высокой коррозионной активностью и разрушающим действием на пластик [10, 11]. С помощью пероксидсодержащих соединений сложно удалить короткие фрагменты ДНК с низкой молекулярной массой [12].
Открытые ультрафиолетовые облучатели на протяжении многих лет применяют для ликвидации контаминации в лабораториях, использующих методы амплификации нуклеиновых кислот (МАНК) [9]. Механизм повреждения ДНК при воздействии коротковолнового УФ излучения основан на способности молекул нуклеиновых кислот поглощать его кванты в области от 200 до 315 нм, в результате чего происходит фотодимеризация пиримидиновых оснований - главным образом, тимина. Также под влиянием УФ излучения могут происходить и другие фотоиндуцированные реакции с формированием димеров цитозин-цитозин или тимин-цитозин, а также реакции фотогидратации цитозина и урацила, которые инициируются фотонами в различных спектральных полосах УФС-излучения [14].
Не так давно появилась современной инновационная технология - импульсное бактерицидное УФ-облучение сплошного спектра. Принцип работы установок основан на плазменно-оптической технологии одномоментной обработки воздуха и открытых поверхностей помещений высокоинтенсивным ультрафиолетовым излучением сплошного спектра, что обеспечивает высокую эффективность в отношении широкого спектра микроорганизмов всех рангов природной устойчивости независимо от этапов и стадий их развития и распространения. Они предназначены для работы в отсутствии людей, обладают экологической безопасностью, имеют автоматический контроль управления процессом обеззараживания, возможность дистанционного управления, постоянную готовность к работе в широком интервале температур, что особенно важно для обеспечения удобства и безопасности обслуживающего персонала. В этой связи, данную технологию целесообразно применять для совершенствования мероприятий, направленных на инактивацию продуктов ПЦР, в частности ампликонов, служащих причиной возникновения ложноположительных и ложноотрицательных результатов. Внедрение новых технологий и решений позволяет повышать экономическую эффективность работы лаборатории и снижать издержки, связанные с проведением работ по деконтаминации помещений и оборудования.
Цель исследования. Экспериментальная оценка способности импульсного УФ-излучения сплошного спектра плазменных ксеноновых ламп разрушать продукты ПЦР (ампликоны).
Материалы и методы
Для деконтаминации ампликонов использовали установки импульсные ультрафиолетовые производства ООО НПП «Мелитта», Россия: переносную для обеззараживания воздуха и поверхностей «Альфа-09», (далее «Альфа-09») и передвижную для обеззараживания воздуха и поверхностей «Альфа-06» (далее «Альфа-06»), генерирующие высокоинтенсивные импульсы УФ-излучения сплошного спектра в диапазоне 200 – 400 нм. Установку «Альфа-09» размещали на подкатном столике перед открытом окном вытяжного шкафа так, чтобы облучать прямыми лучами тест-объекты, установка «Альфа-06» размещалась на перед открытом окном вытяжного шкафа так, чтобы облучать прямыми лучами тест-объекты. Для постановки реакции ПЦР использовали амплификатор нуклеиновых кислот CFX-96 (BioRad, США).
Деконтаминацию лабораторных поверхностей от ампликонов (коротких фрагментов ДНК размером 117 п.н.) проводили в условиях, имитирующих загрязнение поверхностей лаборатории продуктами ПЦР. Эффективность деконтаминации оценивали по уровню остаточного количества ДНК в смывах с рабочих поверхностей лаборатории до и после облучения.
В качестве модельных образцов ДНК использовали ампликоны, полученные методом ПЦР. Длина ампликона составила 117 пар нуклеотидов, GC-состав составил 50%. Ампликоны в концентрации 1х108 копий/мл наносили по 10 мкл на поверхности пластиковых и стеклянных чашек Петри, а также пластин из нержавеющей стали и алюминия в трех независимых точках для каждого времени экспозиции и высушивали при комнатной температуре. Для контроля исходного уровня контаминации брали смывы с трех точек поверхности. Далее проводили облучение поверхностей импульсной лампой. В качестве отрицательного контроля использовали воду MilliQ в том же объеме. После экспозиции, места нанесения ампликонов протирали ватным тампоном, смоченным ТЕ-буфером (рН 8.0) и помещали в отдельные пробирки с ТЕ-буфером (рН 8.0). Из полученных образцов проводили выделение ДНК с помощью комплекта реагентов «Рибо-преп» (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия). Выделение ДНК было необходимо проводить для очистки от ингибиторов ПЦР, которые могут быть на исследуемой поверхности. Отсутствие ингибирования ПЦР подтверждали с помощью внутреннего контрольного образца ВКО-FL (производство ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия).
Для контроля исходного уровня контаминации (исходное количество ампликонов) ампликоны наносили на такие же поверхности, высушивали и хранили при комнатной температуре без обработки УФ-лампами или установками «Альфа-09» и «Альфа-06». Далее, по описанной выше процедуре, ампликоны смывали ватным тампоном, проводили экстракцию и последующую ПЦР.
Эффективность деконтаминации представляли в виде десятичных логарифмов средних значений концентраций ампликонов в смывах с обработанных поверхностей. Стандартное отклонение при определении воспроизводимости между повторами составило менее 0,3 lg коп/мл, что является достаточным для количественного определения с использованием МАНК [13].
Результаты
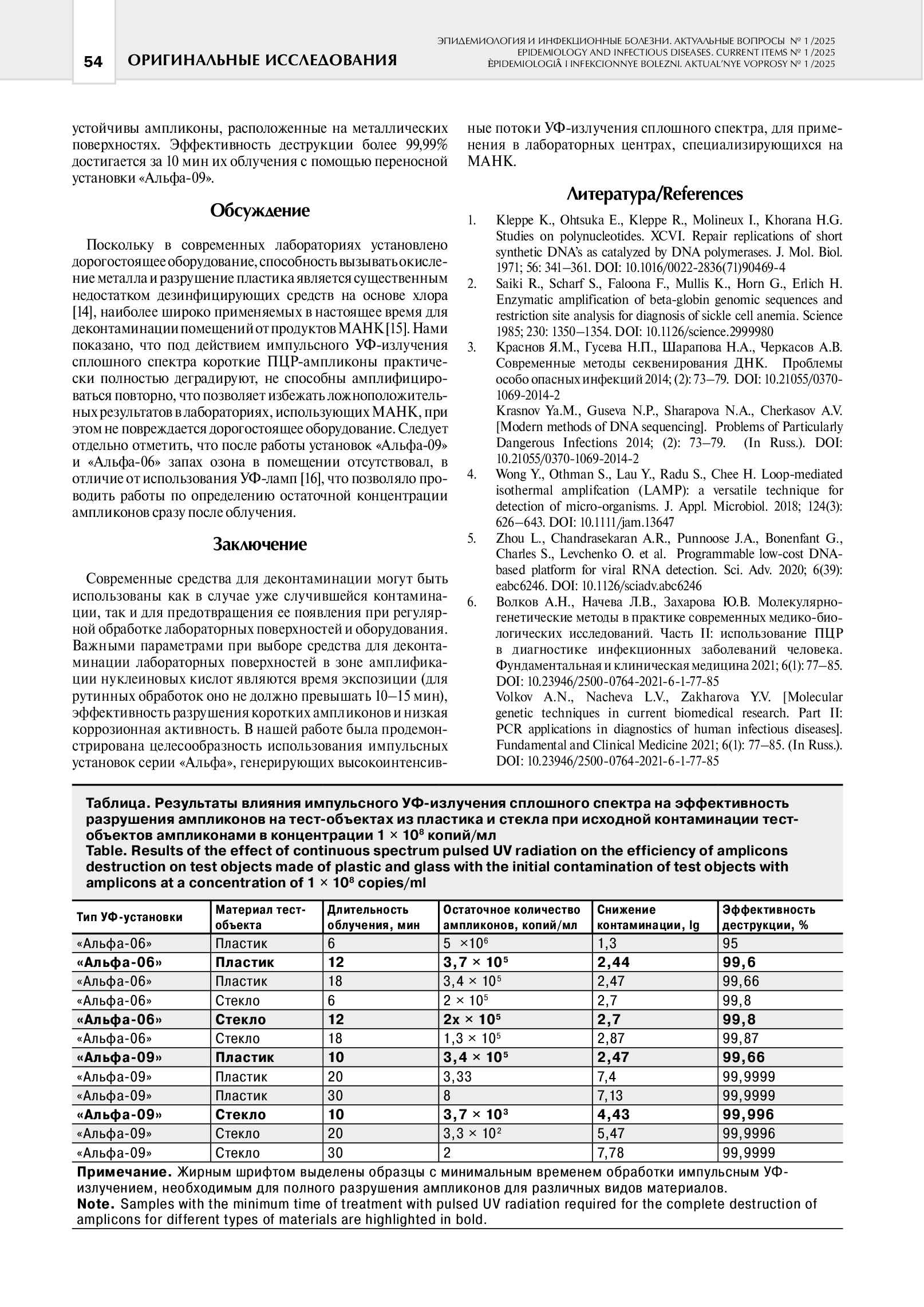
Результаты исследования активности импульсного ультрафиолетового излучения сплошного спектра, генерируемого установками «Альфа-09» и «Альфа-06», по разрушению ампликонов, на тест-поверхностях из пластика, стекла и металла представлены в таблице 1.
Таблица 1. Результаты влияния импульсного УФ-излучения сплошного спектра на эффективность разрушения ампликонов на тест-объектах из пластика и стекла при исходной контаминации тест-объектов ампликонами в концентрации 1х108 копий/мл.
| Тип УФ установки | Материал тест-объекта | Длительность облучения, минут |
Остаточное количество ампликонов, коп./мл. |
Снижение контаминации, Lg | Эффективность деструкции, % |
|
«Альфа-06»
|
пластик |
6 |
5х106 |
1,3 |
95% |
|
«Альфа-06» |
пластик |
12 |
3,7х105 |
2,44 |
99.6% |
|
«Альфа-06» |
пластик |
18 |
3,4х105 |
2,47 |
99,66% |
|
«Альфа-06» |
стекло |
6 |
2х105 |
2,7 |
99,8% |
|
«Альфа-06» |
стекло |
12 |
2х105 |
2,7 |
99,8% |
|
«Альфа-06» |
стекло |
18 |
1,3х105 |
2,87 |
99,87% |
|
«Альфа-09» |
пластик |
10 |
3,4х105 |
2,47 |
99.66% |
|
«Альфа-09» |
пластик |
20 |
3,33 |
7,4 |
99.9999% |
|
«Альфа-09» |
пластик |
30 |
8 |
7,13 |
99,9999% |
|
«Альфа-09» |
стекло |
10 |
3,7х103 |
4,43 |
99,996% |
|
«Альфа-09» |
стекло |
20 |
3,3х102 |
5,47 |
99.9996% |
|
«Альфа-09» |
стекло |
30 |
2 |
7,78 |
99.9999% |
Было показано, что максимальная эффективность деструкции ампликонов (более 99,99%) достигается с помощью переносной установки «Альфа-09» уже через 12 минут облучения. Передвижная установка «Альфа-06» за 12 минут обеспечивает эффективность деструкции ампликонов более 99%, что связано с ее большей удаленностью от облучаемых тест-объектов.
Таким образом, импульсное УФ-излучение, генерируемое ксеноновыми безртутными лампами, ранее зарекомендовавшие себя, как высокоэффективный метод обеззараживания воздуха и поверхностей помещений медицинских организаций, обладает высокой эффективностью деструкции ампликонов (до 100%), на поверхностях из всех исследованных материалов: пластике, стекле и металле. Наименее устойчивы ампликоны расположенные на металлических поверхностях. Эффективность деструкции более 99,99% достигается за 10 минут их облучения с помощью переносной установки «Альфа-09».
Обсуждение
Поскольку в современных лабораториях установлено дорогостоящее оборудование, способность вызывать окисление металла и разрушение пластика является существенным недостатком дезинфицирующих средств на основе хлора[14], наиболее широко применяемых в настоящее время с целью деконтаминации помещений от продуктов МАНК[15]. Нами было показано, что под действием импульсного УФ-излучения сплошного спектра короткие ПЦР-ампликоны практически полностью деградируют, не способны амплифицироваться повторно, что позволяет избежать ложноположительных результатов в лабораториях, использующих МАНК, при этом не повреждается дорогостоящее оборудование. Следует отдельно отметить, что после работы установок «Альфа- 09» и «Альфа-06» запах озона в помещении отсутствовал, в отличие от использования УФ-ламп [16], что позволяло проводить работы по определению остаточной концентрации ампликонов сразу после облучения.
Заключение
Современные средства для деконтаминации могут быть применимы как в случае уже случившейся контаминации, так и для предотвращения ее появления при регулярной обработке лабораторных поверхностей и оборудования. Важными параметрами при выборе средства для деконтаминации лабораторных поверхностей в зоне амплификации нуклеиновых кислот являются время экспозиции (для рутинных обработок оно должно быть не более 10-15 минут), эффективность разрушения коротких ампликонов и низкая коррозионная активность. В нашей работе была продемонстрирована целесообразность использования импульсных установок серии «Альфа», генерирующих высокоинтенсивные потоки УФ-излучения сплошного спектра, для применения в лабораторных центрах, специализирующихся на методах амплификации нуклеиновых кислот.
Список литературы
- Kleppe K., Ohtsuka E., Kleppe R., Molineux I., Khorana H.G. Studies on polynucleotides. XCVI. Repair replications of short synthetic DNA's as catalyzed by DNA polymerases. /J. Mol. Biol. 1971; 56: 341-361. doi:10.1016/0022-2836(71)90469-4.
- Saiki R., Scharf S., Faloona F., Mullis K., Horn G., Erlich H. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. /Science 1985. – V.230. P. 1350–1354. DOI: 10.1126/science.2999980
- Краснов Я.М., Гусева Н.П., Шарапова Н.А., Черкасов А.В./Современные методы секвенирования ДНК // Проблемы особо опасных инфекций. – 2014 - №2. – С. 73-79 doi.org/10.21055/0370-1069-2014-2.
- Wong Y., Othman S., Lau Y., Radu S, Chee H. Loop-mediated isothermal amplifcation (LAMP): a versatile technique for detection of micro-organisms. J Appl Microbiol. 2018;124(3):626-643. https: //doi. org/ 10.1111/jam. 13647
- Zhou L., Chandrasekaran A.R., Punnoose J.A., Bonenfant G., Charles S., Levchenko O. et al./ Programmable low-cost DNA-based platform for viral RNA detection. Sci Adv. 2020;6(39):eabc6246. https:// doi. org/10.1126/sciadv.abc6246
- Волков А.Н., Начева Л.В., Захарова Ю.В. /Молекулярно-генетические методы в практике современных медико-биологических исследований. Часть II: использование ПЦР в диагностике инфекционных заболеваний человека// Фундаментальная и клиническая медицина. 2021; 6(1): 77-85. https://doi.org/10.23946/2500-0764-2021-6-1-77-85
- Туполева Т.А., Тихомиров Д.С., Грумбкова Л.О., Игнатова Е.Н., Романова Т.Ю., Филатов Ф.П., Гаранжа Т.А. / Контаминация при ПЦР-исследованиях: проблемы и решения// Клиническая лабораторная диагностика – 2015. – Т.60.- № 1. С. 26, 39-42 ISSN: 0869-2084
- Jinno Y., Yoshiuraand K., Niikawa N. Use of psoralen as extinguisher of contaminated DNA in PCR/ Nucleic Acids Research, 1990. - Vol. 18. № 22. P. 6739 DOI:10.1093/nar/18.22.6739
- МУ 1.3.2569-09. 1.3. Эпидемиология. Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности. Методические указания (утв. Роспотребнадзором 22.12.2009).
- Алиев А.А., Шапиев Б.И., Алиев Н.А. Коррозионная активность дезинфицирующего средства для обработки помещений и объектов на основе нейтрального анолита // Известия Дагестанского государственного педагогического университета. Естественные науки, 2018. – № 4. – С.5-10.
- Брико Н.И., Зуева Л.П., Покровский В.И. и др. Эпидемиология: Учебник в 2 томах. Т.1. – М.: ООО «Медицинское информационное агенство», 2012.- 768 с.
- Champlot S, Berthelot C, Pruvost M, et al. An Efficient Multistrategy DNA Decontamination Procedure of PCR Reagents for Hypersensitive PCR Applications // PLoS ONE, 2010. – No. 5(9). – P. 130-42. doi:10.1371/journal.pone.0013042 10.
- Karlen Y., McNair A., Perseguers S., et al. Statistical significance of quantitative PCR // BMC Bioinformatics, 2007. – No. 20(8). – P. 131. doi: 10.1186/1471-2105-8-131
References
- Kleppe K., Ohtsuka E., Kleppe R., Molineux I., Khorana H.G. Studies on polynucleotides. XCVI. Repair replications of short synthetic DNA's as catalyzed by DNA polymerases. /J. Mol. Biol. 1971; 56: 341-361. doi:10.1016/0022-2836(71)90469-4.
- Saiki R., Scharf S., Faloona F., Mullis K., Horn G., Erlich H. Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. /Science 1985. – V.230. P. 1350–1354. DOI: 10.1126/science.2999980
- Krasnov Ya.M., Guseva N.P., Sharapova N.A., Cherkasov A.V./Modern methods of DNA sequencing // Problems of especially dangerous infections// – 2014 - №2. – P. 73-79 doi.org/10.21055/0370-1069-2014-2.
- Wong Y., Othman S., Lau Y., Radu S, Chee H. Loop-mediated isothermal amplifcation (LAMP): a versatile technique for detection of micro-organisms. J Appl Microbiol. 2018;124(3):626-643. https: //doi.org/ 10.1111/jam.13647
- Zhou L., Chandrasekaran A.R., Punnoose J.A., Bonenfant G., Charles S., Levchenko O. et al./ Programmable low-cost DNA-based platform for viral RNA detection. Sci Adv. 2020;6(39):eabc6246. https: //doi.org/10.1126/sciadv.abc6246
- Volkov A.N., Nacheva L.V., Zakharova Y.V. /Molecular genetic techniques in current biomedical research. Part II: PCR applications in diagnostics of human infectious diseases. //Fundamental and Clinical Medicine. 2021; 6(1): 77-85. https: //doi. org /10.23946/2500-0764-2021-6-1-77-85
- T Кузин В.В., Колупаева Н.В., Щербакова О.А., Дятлов И.А. Деконтаминация поверхностей от нуклеиновых кислот аэрозолями дезинфицирующих средств. Microbiology Independent Research Journal 2023; 10(1): 1–12. DOI: 10.18527/2500-2236 2023-10-1-1-12.
- Jinno Y., Yoshiuraand K., Niikawa N. Use of psoralen as extinguisher of contaminated DNA in PCR/ Nucleic Acids Research, 1990. - Vol. 18. № 22. P. 6739 DOI:10.1093/nar/18.22.6739
- Алиев А.А., Шапиев Б.И., Алиев Н.А. Коррозионная активность дезинфицирующего средства для обработки помещений и объектов на основе нейтрального анолита. Известия Дагестанского государственного педагогического университета. Серия: Естественные и точные науки 2018; 12(4): 5–10. DOI:10.31161/1995-0675-2018-12-4-5-
- Mwangi P., Mogotsi M., Ogunbayo A., Mooko T., Maringa W. A decontamination strategy for resolving SARS-CoV-2 amplicon contamination in a next-generation sequencing laboratory. Arch. Virol. 2022; 167(4): 1175–1179. DOI:10.1007/s00705-022-05411-z
- Champlot S, Berthelot C, Pruvost M, et al. An Efficient Multistrategy DNA Decontamination Procedure of PCR Reagents for Hypersensitive PCR Applications // PLoS ONE, 2010. – No. 5(9). – P. 130-42. doi:10.1371/journal.pone.0013042
- Волынкина А.С., Рязанова А.Г., Русанова Д.В., Куличенко А.Н. Проблема ДНК (РНК)-контаминации в лаборатории при проведении диагностики COVID-19 мето дом ПЦР. Здоровье населения и среда обитания 2021; (7): 76–81. DOI: 10.35627/2219-5238/2021-29-7-76-81
- Karlen Y., McNair A., Perseguers S., et al. Statistical significance of quantitative PCR // BMC Bioinformatics, 2007. – No. 20(8). – P. 131. doi: 10.1186/1471-2105-8-131
- Sicairos-Ruelas E.E., Gerba C.P., Bright K.R. Efficacy of copper and silver as residual disinfectants in drinking water. J. Environ. Sci. Health A Tox. Hazard Subst. Environ. Eng. 2019; 54(2): 146–155. DOI: 10.1080/10934529.2018.1535160
- Farrer A.G., Wright S., Skelly E., Eisenhofer R., Dobney K., Weyrich L. Effectiveness of decontamination protocols when analyzing ancient DNA preserved in dental calculus. Sci. Rep. 2021; 11(1): 7456. DOI: 10.1038/s41598-021-86100-w
- Soro A., Ekhlas D., Shokri S., Yem M., Li R., Barroug S. The efficiency of UV light-emitting diodes (UV-LED) in decontaminating Campylobacter and Salmonella and natural microbiota in chicken breast, compared to a UV pilot-plant scale device. Food Microbiology 2023; 116: 104365. DOI: 10.1016/j. fm.2023.104365