


УДК 579.65+577.344.2
Применение импульсных УФ-технологий для обеспечения микробиологической чистоты при подготовке миссий, к которым предъявляются требования планетарной защиты
ДешеваяЕ.А.1, ФиалкинаС.В.1, ГуридовА.А.1, ХамидуллинаН.М.2 , ШашковскийС.Г.3 ,КиреевС.Г.3, ЗахаренкоД.В.2
1ГНЦ РФ – Институт медико-биологических проблем РАН, Хорошевское шоссе, 76-А, Москва, Россия
2АО «НПО Лавочкина»Ленинградская ул., д. 24, г. Химки, Московская область, Россия
3ООО «НПП «Мелитта»
e-mail: dehsevaya @imbp.ru
В работе экспериментально показана возможность глубокого обеззараживания открытых поверхностей элементов конструкции модулей летательных автоматических аппаратов, в том числе сложной формы, высокоинтенсивными потоками ультрафиолетового излучения. Определены режимы и способы, обеспечивающие высокую эффективность обеззараживания поверхностей из различных материалов (полимеры, светочувствительные матрицы, полупроводники, металлы и т.д.) от наиболее устойчивых к ультрафиолету споровых форм бактерии.
В работе экспериментально показана возможность использования импульсного ультрафиолетового излучения в качестве физического фактора, обладающего стерилизующим действием для поверхностного обеззараживания больших конструкционных элементов модулей при проведении необходимых сборочных работ. Определена эффективность антимикробного воздействия импульсного УФ-излучения на штаммы микроорганизмов, контаминирующие элементы модулей, имеющие поверхности разной конфигурации. Обоснованы дозы радиационного воздействия импульсного ультрафиолетового излучения (ИУФИ), обеспечивающие максимальное обеззараживание материалов от споровых бактерий.
Ключевые слова: элементы модулей, планетарная защита, импульсное ультрафиолетовое излучение, микроорганизмы, споровые бактерии рода Bacillus
К экспедициям на Марс предъявляются особые требования по планетарной защите. Это связано с тем, что, по мнению ряда ученых [1-4], при изучении планеты могут представиться различные возможности от обнаружения сложных органических соединений или продуктов абиогенного синтеза и до существования развитых форм жизни. В настоящее время существует гипотеза о возможности наличия жизни на планете в подповерхностном слое. Одной из задач планетарной защиты является исключение возможности занесения земных форм жизни на планету, так как это препятствует изучению данной планеты в присущих ей условиях.
В связи с этим, к миссиям на Марс предъявляются следующие требования по планетарной защите:
-
к десантному модулю (ДМ), несущему посадочную платформу с марсоходом – требования категории IVа, характерные для экспедиции посещения без поисков жизни;
-
к марсоходу с аппаратурой, предназначенной для проведения биологических экспериментов по поиску жизни на Марсе, - требования категории IVb по классификации КОСПАР [5].
Так как для экспедиций категории IVа определен верхний предел биологической нагрузки - общее количество спор (поверхностное и объемное), которое допускается при посадке на Марс (ДМ + несгоревшие обломки перелетного модуля (ПМ), попадающие на поверхность Марса), не должно превышать 5•105 бактериальных спор, то возникает необходимость снижения бионагрузки оборудования с использованием всех приемлемых методов обеззараживания, совместимых с конструкционными материалами ДМ, на каждом этапе сборки космического аппарата (КА).На первоначальном этапе все оборудование и элементы конструкций следует деконтаминировать до минимального уровня бактериальных спор на один элемент изделия. Для выполнения данного положения рекомендовано применить разные методы стерилизации - тепловая, радиационная или газовая. Эти методы инактивации микроорганизмов могут быть использованы для изделий, которые можно поместить в камеры радиационной, газовой или тепловой стерилизации. Кроме этого, перед выбором метода стерилизации элементов, поступающих на сборку ДМ, проводился анализ возможности применения какого – либо из выше перечисленных методов подавления жизнеспособности микроорганизмов с учетом материаловедческих особенностей каждого элемента ДМ. Так мелкие металлические элементы подвергались радиационной стерилизации, а тепловое воздействие применяли к элементам, не устойчивым к радиации. Некоторые не крупные элементы конструкций подвергали газовой стерилизации.
Для поверхностного обеззараживания крупногабаритных элементов ДМ был разработан специальный комплексный метод. Он состоял из предварительной спиртовой очистки поверхностей с последующей импульсной ультрафиолетовой обработкой. Первоначально с обрабатываемой поверхности удаляли загрязнения, которые могли экранировать импульсное УФ-излучение, а затем обеззараживали поверхность изделия или элемента изделия потоками УФ-излучения, генерируемого импульсной ксеноновой лампой установки УИКб-01- «Альфа».
Известно, что механизмы инактивации клетки монохроматическим излучением (например, излучением ртутных ламп низкого давления на длине волны 254 нм) и УФ-излучением сплошного спектра отличаются. Облучение клетки УФ излучением широкого спектрального состава (200-300 нм) вызывает многоканальные повреждения одновременно в ДНК, РНК, белках, мембранах и других жизненно-важных компонентах клетки в отличие от монохромных источников, что приводит к снижению резистентности микроорганизмов и, соответственно, значительно повышает биоцидную эффективность такого воздействия на облучаемые объекты [6-12].
В проведенных ранее исследования активности УФ-излучения широкого спектрального состава в отношении полирезистентных штаммов было установлено, что для снижения микробного загрязнения спорообразующими бактериями поверхности чашек Петри на 5-6 порядков, требуются облучение в спектральном диапазоне УФ-С [13, 14]. Такой уровень исходной контаминации поверхностей споровыми микроорганизмами часто принимается за максимально возможное загрязнение изделий и/или их элементов при первоначальной сборке в чистом помещении класса 8 ИСО НС.
Материалы и методы
Источником УФ-излучения сплошного спектра была импульсная ксеноновая лампа серийной медицинской установки УИКб-01-«Альфа». Для удобства проведения экспериментов лампа извлекалась из установки и крепилась к стойке параллельно основанию, на котором располагались чашки Петри с тест-культурами, на расстоянии 30 см (рисунок 1). Импульсная ксеноновая лампа U-образной формы обладала разрядным каналом длиной 310 мм и диаметром 7 мм. Лампа генерировала световые импульсы пиковой мощностью около 3 МВт и длительностью примерно 100 мкс, следующие с частотой 2,5 Гц.
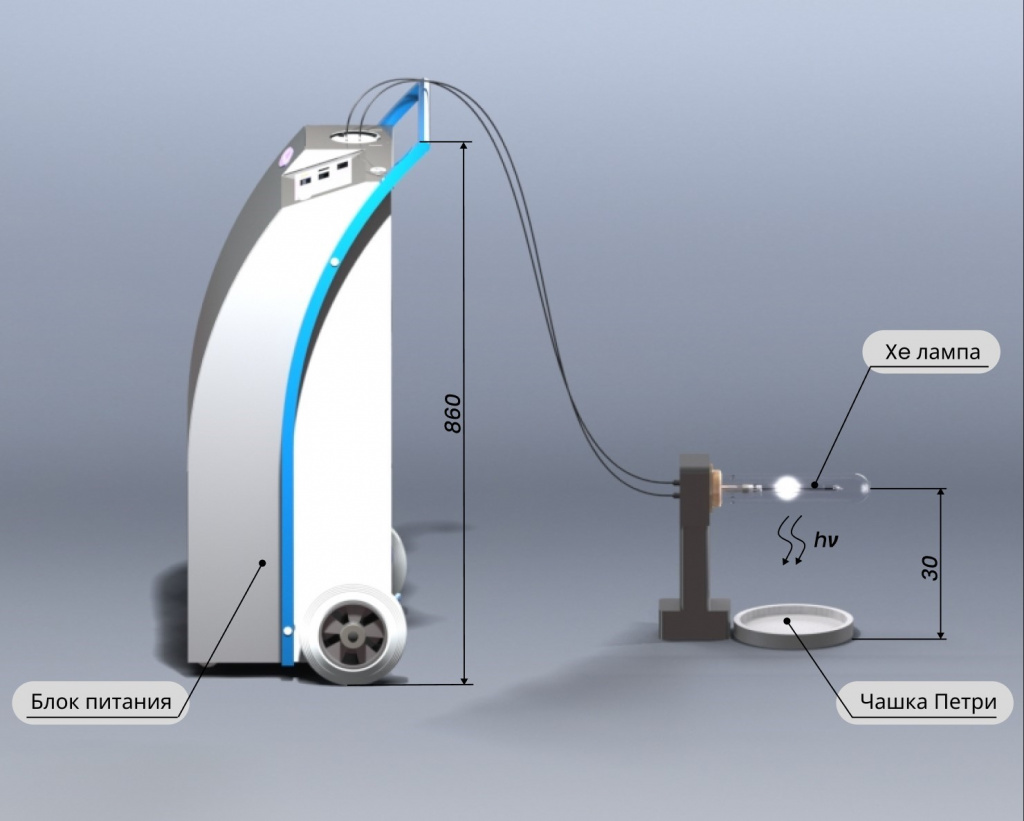
Рисунок 1 – Схема размещения тест-объектов при использовании УИКб-01-«Альфа»
Тест-объекты, в качестве которых использовали чашки Петри, инфицированные ассоциациями микроорганизмов, размещали под лампой на основании стойки, перпендикулярно геометрическому центру лампы. Для равномерного облучения поверхности чашек их размещали по одной под импульсной лампой.
В качестве тест-культур для исследования инактивирующего действия импульсного УФ-излучения использовали спорообразующие бактерии, выделенные из среды чистых помещений предприятий, в которых предполагалось проводить сборочные работы, следующих видов: Bacillus spumilus, Bacillus vallismortis, Bacillus subtilis, Bacillus megaterium, Bacillus smojavensis (далее ассоциация бактерий).Для приготовления взвеси каждой тест-культуры покоящиеся формы спорообразующих бактерий использовали суточную культуру, выращенную на плотной питательной среде (трипказо-соевый агар) при температуре 37оС. Затем, для стимулирования спорообразования у бактерий рода Bacillus, готовили суспензию каждой отдельной культуры в физиологическом растворе и рассевали ее на поверхность картофельного агара, разлитого в стерильные чашки Петри, в объеме 0,2-0,5 мл на чашку. Инкубирование посевов производили в течение 48 часов при температуре 37оС в термостате. По истечении 48 - часовой инкубации чашки Петри с посевами вынимали из термостата и дополнительно выдерживали при комнатной температуре (20-22 о С) в присутствии естественного источника света в течение 5 суток.
В дальнейшем проводили контрольное исследование тест-культур бактерий, выращенных на картофельном агаре. Взвесь (смыв) каждой тест-культуры бактерий готовили в стерильном физиологическом растворе, используя эталонный стеклянный стандарт мутности на 10 единиц, что соответствует количеству микробных клеток 1 млрд/мл. Затем серией последовательных разведений в стерильном физиологическом растворе добивались концентрации взвеси каждого тест-микроорганизма, равной 105-6 клеток в 1 мл.
Для получения ассоциации споровых бактерий суспензии каждого вида смешивали в равных количествах.
В качестве подложки на данном этапе использовали стерильные чашки Петри, заражение поверхности донышка которых осуществляли путем равномерного нанесения приготовленной взвеси ассоциации спор бактерий, с помощью пипетки из расчета 104-5 колониеобразующих единиц (КОЕ) на 1 см2 площади для бактерий.
В первой серии экспериментов ассоциации бактерий наносили на сухую поверхность чашек Петри (площадь чашки 63,6 см2), а поверхность донышка чашек перед нанесением суспензии микроорганизмов предварительно протирали спиртом. Для исследования влияния этанола на эффективность обеззараживания импульсным УФ-излучением на поверхности донышка чашки наносились капельки спирта этанола. Затем чашки, с нанесенными на их поверхность микробными ассоциациями, облучались потоками импульсного УФ-излучения, генерируемого импульсной ксеноновой лампой, расположенной на стойке (рисунок 1).Время воздействия составляло 1 и 2 минуты, а расстояние до облучаемой поверхности донышка чашки - 30см.
Отбор проб с облучаемых поверхностей производили тампоном (FLOQSwab, 552C). Тампон отбалтывали в 2,5 мл стерильной воды. Далее асептически (в ламинарном шкафу) с помощью пипетки наносили 5 мл аликвоты в 5 чашек Петри. Затем добавляли по 20 мл стерильного агара R2A, имеющего температуру 48°C - 50°C, в каждую чашку Петри и, медленно вращая, перемешать содержимое до затвердения при комнатной температуре. Чашки с посевами термостатировали при 320С в течение 48 часов. После истечения времени инкубации проводили подсчет выживших колоний по методике, принятой при контроле чистых помещений с учетом коэффициента потери при посеве одного тампона равном 0,45 [15]. По результатам оценивалась эффективность инактивации бактерий, инокулирующих ровные поверхности конструкционных материалов, импульсным УФ-излучением.
Во второй серии экспериментов изучалось влияние этанола на активность импульсного УФ-излучения на расстояниях от 0,3 до 1 метра до тест-объекта. Экспозиции облучения тест-объектов в опытах составляли от 2 до 20 минут соответственно. Эта серия экспериментов позволила определить экспозицию воздействия, обеспечивающую требуемую эффективность обеззараживания поверхности объекта.
Образцы материалов помещали в чашки Петри и заражали ассоциациями бактерий. В качестве контроля использовали поверхность полимерной чашки Петри.
Ассоциацию бактерий приготавливали по методике, описанной ранее. Затем ее пипеткой наносили на поверхность исследуемого материала и подсушивали до высыхания капель.
В третьей серии экспериментов исследовалась возможность высокоэффективного обеззараживания сложных поверхностей, находящихся в разных плоскостях относительно направления излучения, формируемого лампой. Для выравнивания облученности обрабатываемых поверхностей тестируемых объектов дополнительно использовались зеркала, перенаправляющие излучение в теневые зоны.
Расположение мест нанесения ассоциации бактерий представлены на рисунке 2. На материалы наносились ассоциации микроорганизмов. Области нанесения показаны на рисунке 2. Площадь заражения составляла около 25 см2. На каждое изделие было нанесено не менее пяти повторности ассоциации бактерий.

Рисунок 2 - Тест – объекты и места нанесения ассоциации спорообразующих бактерий МНА – места нанесения ассоциации спорообразующих бактерий (мБ)
Схема проведения эксперимента: для облучения тест-объектов использовалось, как прямое излучение, так и отражённое, для этого на подложке размещались алюминиевые отражатели, а сами тест-объекты подвешивались. Время облучения составляло 2 и 20 минут.
Облучение тест-объектов проводили сначала с одной стороны, а затем поворачивали на 180 градусов вокруг оси для облучения затененной при первом облучении стороны. Таким образом, дважды проводилось облучение одного тест-объекта по 2 и 20 минут.
Объекты подвешивались, так чтобы заражённые участки были под углом 45º относительно плоскости отражателя. Повторность всех экспериментов была трехкратная.
Результаты и обсуждения
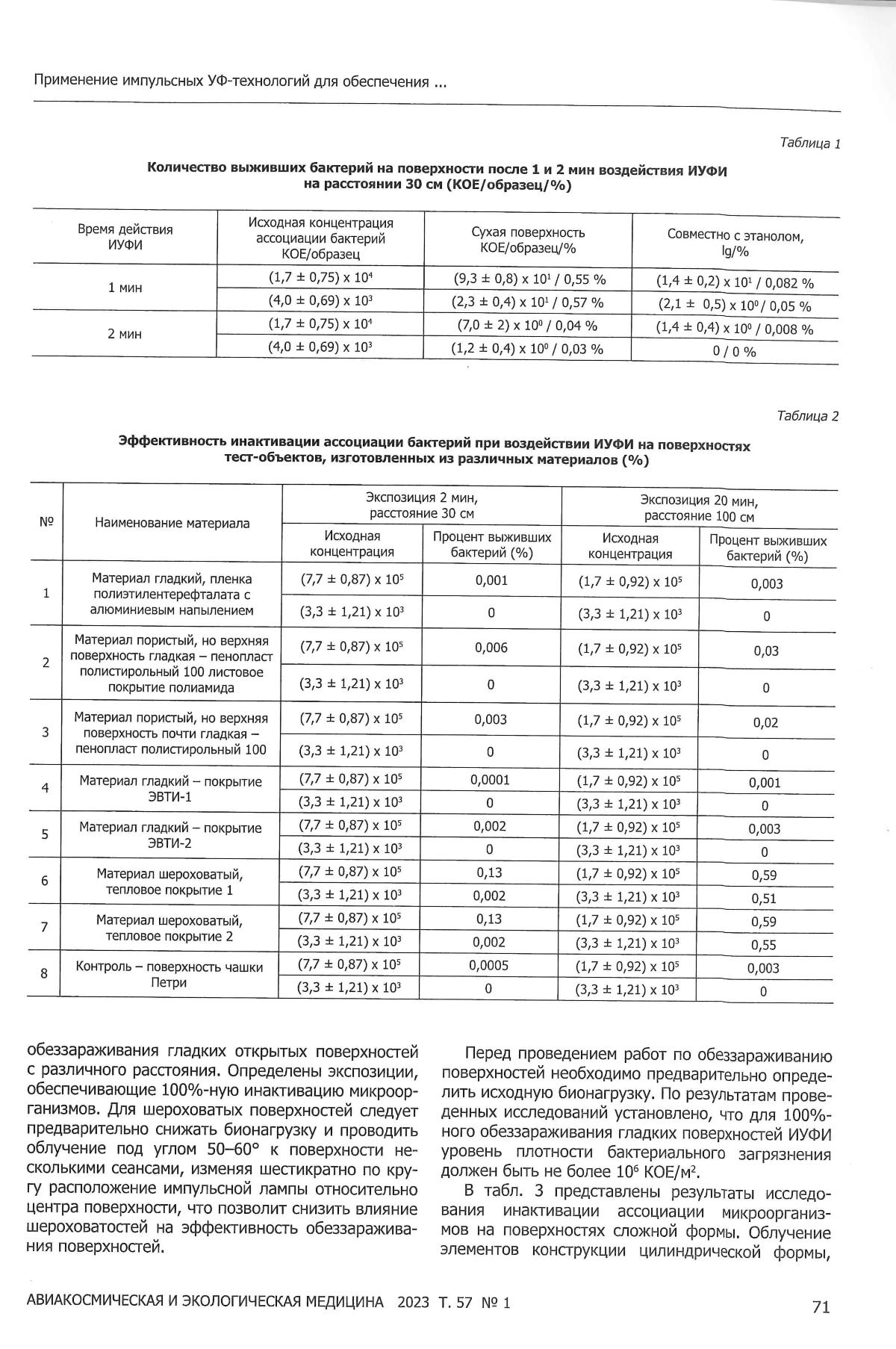
В таблице 1 представлены результаты микробиологических исследований воздействия ИУФИ на ассоциацию бактерий.
Таблица 1–Эффективность обеззараживания в логарифмическом масштабе и процент выживших бактерий на поверхности,облучаемых чашек с расстояния 30 см ( lg / %)
|
Время действия ИУФИ |
Исходная концентрация ассоциации бактерий КОЕ/образец |
Сухая поверхность чашки lg / % |
Совместно с этанолом lg / % |
|
1 минута
|
(1.7±0,75) х 104 |
2,26/ 0,54% |
3,1/ 0,08% |
|
(4,0±1,6) х103 |
2,24/0,57% |
3,3/ 0,05% |
|
|
2 минуты |
(1.7±0,83) х104 |
3,4 / 0,04% |
4,1 / 0,008% |
|
(4,0±0,69) х103 |
3,5 / 0,03% |
3,6 / 0% |
Из представленных в таблице 1 результатов видно, что при экспозиции образцов импульсным ультрафиолетовым облучением в течение 1 минуты сохранялись жизнеспособные единицы бактерий. При этом выявлена корреляция влияния исходной концентрации ассоциации бактерий, а также присутствия этанола, на степень подавления микроорганизмов. Так, при действии ИУФИ на ассоциацию бактерий, нанесенную на сухую поверхность чашки (гладкая поверхность), инактивация в среднем составляла 2,25lg / 0,55%, а в присутствии этанола – 3,2lg / 0,0065%. Следовательно, показано, что независимо от уровня исходной ассоциации бактерий снижение численности жизнеспособных микроорганизмов было одного порядка. Совместное действие этанола и УФ-излучения привело к росту эффективности обеззараживания тест-объектов. Соответственно, степень снижения количества жизнеспособных микроорганизмов было также одинаковым не зависимо от уровня исходной контаминации.
Полученная тенденция была четко подтверждена при двухминутном воздействии импульсного ультрафиолетового облучения.
При облучении тест-объектов с экспозицией 2 минуты степень снижения численности жизнеспособных микроорганизмов увеличилась до 3,4-3,5lg / 0,04- 0,03% не зависимо от исходной контаминации. Дополнительное воздействие этанола увеличило эффективность обеззараживания до 4,1lg / 0, 008%, а при снижении исходной контаминации до (4,0±1,6) х103 было достигнуто 100% обеззараживание.
Полученные результаты в первой серии экспериментов позволяли определить необходимую экспозицию облучения открытых поверхностей. Показано, что при исходной концентрации бактерий, составляющей 4,0х103 КОЕ /образец ИЛИ 5,5х105 КОЕ/м2, и при предварительном нанесении этанола на облучаемую поверхность, минимальная экспозиция воздействия импульсным УФ-излучением на ровную поверхность полимерных материалов должно быть не менее 2 минут для полной инактивации споровых бактерий. В проведенных экспериментах отмечено дополнительное усиление антимикробного действия ИУФИ со спиртом. Спирт обладает способностью образовывать ацетальдегид, снижая барьерные свойства мембраны клетки. Однако, это действие спирта неспецифично и определяется его полярным и неполярным взаимодействием с мембраной клетки из-за наличия сильных водородных связей, образующихся в результате поляризации оксигрупп. Вероятно, это свойство спирта усиливало противомикробное действие ИУФИ.
В таблице 2 представлены результаты исследования антимикробной активности импульсного УФ-излучения при контаминации различных материалов. В качестве тест-объектов использовались материалы, которые могут применяться в конструкции элементов ДМ.
Таблица 2 – Эффективность инактивации ассоциации бактерий при воздействии ИУФИ на поверхностях тест-объектов, изготовленных из различных материалов (%)
|
№ |
Наименование материала |
Экспозиция 2 минуты, Расстояние 30 см |
Экспозиция 20 минут, Расстояние 100 см |
||
|
Исходная концентрация |
Процент выживших бактерий (%) |
Исходная концентрация |
Процент выживших бактерий (%) |
||
|
1 |
Материал гладкий пленка полиэтилентерефталата с алюминиевых напылением |
(7.7±0,87) х105 |
0,001 |
1,7х105±0,92 |
0,003 |
|
(3,3±1,21) х103 |
0 |
3.3х103±1,21 |
0 |
||
|
2 |
Материал пористый, но верхняя поверхность гладкая- пенопласт полистирольный 100 листовое покрытие полиамида |
(7.7±0,87) х105 |
0,006 |
1,7х105±0,92 |
0,03 |
|
(3,3±1,21) х103 |
0 |
3.3х103±1,21 |
0 |
||
|
3 |
Материал пористый, но верхняя поверхность почти гладкая- пенопласт полистирольный 100 |
(7.7±0,87) х105 |
0,003 |
1,7х105±0,92 |
0,02 |
|
(3,3±1,21) х103 |
0 |
3.3х103±1,21 |
0 |
||
|
4 |
Материал гладкий - покрытие ЭВТИ -1 |
(7.7±0,87) х105 |
0,0001 |
1,7х105±0,92 |
0,001 |
|
(3,3±1,21) х103 |
0 |
3.3х103±1,21 |
0 |
||
|
5 |
Материал гладкий - покрытие ЭВТИ 2 |
(7.7±0,87) х105 |
0,002 |
1,7х105±0,92 |
0,003 |
|
(3,3±1,21) х103 |
0 |
3.3х103±1,21 |
0 |
||
|
6 |
Материал шероховатый, тепловое покрытие -1 |
(7.7±0,87) х105 |
0,13 |
1,7х105±0,92 |
0,59 |
|
(3,3±1,21) х103 |
0,002 |
3.3х103±1,21 |
0,51 |
||
|
7 |
Материал шероховатый, тепловое покрытие 2 |
(7.7±0,87) х105 |
0,13 |
1,7х105±0,92 |
0,59 |
|
(3,3±1,21) х103 |
0,002 |
3.3х103±1,21 |
0,55 |
||
|
8 |
Контроль - поверхность чашки Петри |
(7.7±0,87) х105 |
0,0005 |
1,7х105±0,92 |
0,003 |
|
(3,3±1,21) х103 |
0 |
3.3х103±1,21 |
0 |
||
Результаты экспериментов, представленных в таблице 2 демонстрируют возможность достижения 100% инактивации микроорганизмов на гладких поверхностях при исходной концентрации не более (3,3±1,21) х103 КОЕ/образец, усредненная площадь которых составляла 25см2. Следовательно, при исходной концентрации споровых бактерий не более 1,2х106 КОЕ/м2 потоки УФ-излучения сплошного спектра способны со 100% эффективностью обеззараживать гладкие поверхности различных материалов при 2 минутной экспозиции на расстоянии 30 см, а при 20 минутном воздействии - на расстоянии 1 м.
При аналогичных условиях (времени и расстоянии) на шероховатых поверхностях снижение численности микроорганизмов составило от 0,87% при исходном заражении (7,7±0,87) х105 КОЕ/образец до 0,002 при исходном заражении (3,3±1,21) х103 , то есть сохранялись единичные бактерии. Это, вероятно, связано с поверхностным действием УФ-излучения, когда часть расположенных микроорганизмов в микронеровностях, в глубине шероховатостей или в других зонах дефектов поверхности не облучаются или облучаются рассеянным светом. Причем эффективность обеззараживания шероховатых поверхностей с расстояния 30 см выше во всех опытах по сравнению с облучением с расстояний 100 см. Вероятно, это связано с влиянием геометрических размеров излучающего канала импульсной ксеноновой лампы. Лампа обладает U-образным телом свечения и при близком расположении лампы появляются лучи, облучающие шероховатости на поверхности под различными углами, что снижает вероятность появления теневых микрозон. При близком расположении лампы появляются лучи, облучающие поверхность под различными углами.
Результаты исследования влияния материалов на эффективность обеззараживания показали, возможность достижения 100% эффективности обеззараживания гладких открытых поверхностей с различного расстояния. Определены экспозиции, обеспечивающие 100% инактивацию микроорганизмов. Для шероховатых поверхностей следует предварительно снижать бионагрузку и проводить облучение под углом 50 – 60 градусов к поверхности несколькими сеансами, изменяя шестикратно по кругу расположение импульсной лампы относительно центра поверхности, что позволит снизить влияние шероховатостей на эффективность обеззараживания поверхностей.
Перед проведением работ по обеззараживанию поверхностей необходимо предварительно определить исходную бионагрузку. По результатам проведенных исследований установлено, что для 100% обеззараживания гладких поверхностей ИУФИ уровень плотности бактериального загрязнения должен быть не более 106 КОЕ/м2.
В таблице 3 представлены результаты исследования инактивации ассоциации микроорганизмов на поверхностях сложной формы. Облучение элементов конструкции цилиндрической формы, предварительно контаминированных ассоциацией бактерий, осуществлялось с использованием алюминиевых отражателей, перенаправляющих излучение импульсной лампы на теневые (закрытые от прямых лучей) зоны облучаемого объекта.
Таблица 3 - Результаты обработки элементов цилиндрических конструкции, контаминированных ассоциацией бактерий.
|
№ |
Материал труб |
Исходная контаминация бактериальной ассоциацией |
||||||
|
(5,6 ±0,78) х104 |
(3,5 ±1,16) х103 |
(3,6±0,79) х104 |
(3,5±0,84) х103 |
|||||
|
Экспозиция 2 минуты совместно с этанолом. |
Экспозиция 20 минут совместно с этанолом. |
|||||||
|
Расстояние до объекта 0,3 м |
Расстояние до объекта 1,0 м |
|||||||
|
|
|
количество инактивированных микроорганизмов (КОЕ/ образец)/ степень снижения исходной контаминации в логарифмическом масштабе и процент выживших бактерий |
||||||
|
1. |
труба №1, (углепластик ) |
3,8lg/0,016 |
3.5lg / 0 |
3.7lg / 0,019 |
3.5lg / 0 |
|||
|
2. |
труба №2 ( металл) |
4.3lg / 0,005 |
3.5lg / 0 |
4.2lg / 0,007 |
3.5lg / 0 |
|||
Из представленных данных видно, что:
-
при исходных концентрациях споровых бактерий от (5,6 ± 0,78) х104 КОЕ/25см2 до (3,6 ±0,79) х104 КОЕ/25см2 эффективность обеззараживания объектов за 2 минуты облучения с расстояния 30 см ( 20 минут с расстояния 100см) составила более 99,9%;
-
при снижении исходной численности споровых бактерий до (3,5±0,84) х103 КОЕ/25см2 и облучении объектов в тех же режимах наблюдается полное подавление жизнеспособных форм микроорганизмов.
В экспериментах по исследованию возможности глубокого обеззараживания поверхностей сложной формы с гладкой поверхностью с использованием отражателей была продемонстрирована 100% инактивация бактериальной ассоциации при исходных концентрациях бактерий (3,5±0,84) х103 КОЕ/ 25см2 (1,2х106 КОЕ/м2) при совместном действии паров этанола и УФ-излучения сплошного спектра в используемых ранее режимах. Показано, что использование отражателей позволит сократить время обработки объектов сложной формы и обеззараживать отдельные элементы конструкции, расположенные на корпусе десантного модуля.
На рисунке 3 представлена возможная схема обработки одного из наиболее сложных по форме элемента конструкции ДМ. Облучение объекта предполагается осуществлять с помощью нескольких импульсных УФ-установок с вынесенными на штативах ксеноновыми лампами с отражателями и расположенными в местах, исключающих наличие теневых зон. Установки должны работать одновременно в отсутствии людей и управляться дистанционно. После каждого сеанса положение ламп необходимо менять для обработки необлученных ранее зон. Время полной обработки объекта будет определяться его размерами и формой (количеством теневых зон).

Рисунок 3 - Схема облучения сложных элемента конструкции ДМ
В результате проведенных исследований была установлена максимально допустимая для предложенных экспозиций облучения с помощью импульсной установки УИКб-01-«Альфа» плотность контаминации споровыми бактериями (1,32 х 106 КОЕ/м2) открытых гладких поверхностей из разных материалов, при которой реализуется 100% их инактивация.
Полученные результаты позволяют рекомендовать следующую последовательность действий. Первоначально при обеззараживании поверхности элементов и/или изделий следует определить расположение элементов конструкции на несущей установке (плате). Затем всю конструкцию разбить на секции, в которых имеются элементы, обладающие поверхностями, закрытыми от прямых лучей (например, тела вращения, уголки, пластина и др.), испускаемой лампой или экранирующие свет от нее на поверхности деталей, расположенных в тени за ними. Для создания бестеневого режима воздействия следует рассчитать количество необходимых ламп, которые должны быть расположены с разных сторон и воздействовать на элемент и/или объект под разным углом, причем длительность обработки с помощью данной установки должна быть увеличена пропорционально квадрату расстояния от лампы до облучаемого объекта. Так при увеличении расстояния до импульсной лампы до 2 метров потребуется увеличить время работы установки в 4 раза по сравнению с временем работы с расстояния 1 метр.
На основании последней серии экспериментов можно заключить, что сокращение времени сеанса обеззараживания может быть обеспечено за счет использования отражателей, расположенных за лампой, которые дополнительно перенаправят излучение, распространяемое вне границ сборки, на облучаемый элемент. Использование отражателя позволит сократить время обработки в К=1,5 - 3 раза в зависимости от формы и материала отражателя.
Обеззараживание сборки желательно проводить одновременно со всех сторон модуля, элемента и/или изделия.
Выводы
-
Было установлено, что при исходной численности концентрации бактерий, составляющей 1,2х106 КОЕ/м2, и при наличие на облучаемой поверхности этанола, 100% эффективность обеззараживания поверхностей достигается при минимальной экспозиции облучения УФ-излучением сплошного спектра импульсной ксеноновой лампой установки УИКб-01-«Альфа» открытой и гладкой поверхности из различных материалов с расстояния 30 см при 2 минутах, а при расстоянии 1 метр – 20 минутах.
-
Метод не применим для обеззараживания пористых поверхностей. Возможна высокая инактивация микроорганизмов на шероховатых поверхностях, но для его реализации требуется дополнительная разработка режимов облучения. Предложенные экспозиции облучения реализуют снижение исходной контаминации на них на 99%.
-
Применение отражателей и дополнительных установок будет сокращать общее время обработки деталей и узлов сложной формы.
-
Метод высокоинтенсивного облучения объектов УФ-излучением сплошного спектра обладает высокой спороцидной эффективностью и может применяться для 100% инактивации открытых поверхностей любых объектов, не нанося им вред.
Работа выполнена в рамках контракта №47702388027160002350/17-12-158/351/МВ-102-2017.
Список литературы
- Rummel J.D. 2001 Planetary exploration in the time of astrobiology: protecting against biological contamination. Proc.Natl. Acad. Sci.USA 98: 2128-2131.
- Труды Института микробиологии им. С.Н.Виноградского / Ин-т микробиологии им. С.Н.Виноградского. – М.: Наука, Вып.: Юбилейный сборник к 70-летию Института / Ота. Ред. В.Ф.Гальченко. – М.: Наука, 2004. – 423 с. – ISBN -02-033286-0
- Rummel, J. D., Beaty, D. W., Jones, M. A., Bakermans, C., Barlow, N. G., Boston, P. J., ... & Wray, J. J. A New Analysis of Mars “Special Regions”: Findings of the Second MEPAG Special Regions Science Analysis Group (SR-SAG2). Astrobiology, 2014, 14, р. 887-968.
- Газенко О.Г., Кальвин М., Основы космической биологии и медицины Москва, Наука, Т.1. 1976г., 202 с.
- COSPAR policy on planetary protection (2021 on 3 June. Prepared by the COSPAR Panel on Planetary Protection and approved by the COSPAR Bureau) COSPAR -2022, 43th Scientific Assembly.
- Kowalski W. Ultraviolet Germicidal Irradiation Handbook. UVGI for Air and Surface Disinfection. - New York.: Springer, 2009. – 501 c.
- Конев С.В., Волотовский И.Д. Фотобиология. – Минск: БГУ, 1979. - 472 с.
- Владимиров Ю.А. Физико-химические основы фотобиологических процессов. – М.: Дрофа, 2006. – 285 с.
- Владимиров Ю.А., Рощупкин Д.И., Потапенко А.Я., Деев А.И. Биофизика. – М.: Медицина, 1983. - 272 с.
- Самойлова К.А. Действие ультрафиолетовой радиации на клетку. – Ленинград: Наука, 1967. – 148 с.
- Жестяников В.Д., Самойлова К.А., Завильгельский Г.Б. Повреждение и репарация клетки при действии коротковолнового и длинноволнового УФ излучения. - Ультрафиолетовое излучение и его применение в биологии. Материалы 10-го Всесоюзного совещания. – Пушино. 1973. С. 7-9.
- Рубин А.Б. Биофизика: В 2 т. Т.2.: Биофизика клеточных процессов. – М.: Изд-во МГУ, 2004. – 469 с.
- Шашковский С.Г., Калинчук Т.А., Поликарпов Н.А., Гольдштейн Я.А., Гончаркенко И.В. Оборудование для обеззараживания помещений в ЛПУ на основе импульсной ультрафиолетовой технологии. // Поликлиника. 2009 г., №3, с.42-46.
- Поликарпов Н.А., Шашковский С.Г., Гольдштейн Я. А., Новикова Н.Д., Дешевая Е.А., Архипов В.П., Желяев И.А. Применение импульсных плазменно-оптических ультрафиолетовых технологий для обеспечения микробиологической безопасности среды обитания космических станций.// Авиакосмическая и экологическая медицина. 2010, №1, с. 40-46.
- ECSS-Q-ST-70-55C Microbial examination of flight hardware and cleanrooms, ESA Requirements and Standards Division ESTEC, P.O. Box 299, 2200 AG Noordwijk, The Netherlands.