- Бактерии
- ЦНИИ эпидемиологии Роспотребнадзора, Москва
- 2019 г.
Отчет о проведении научно-исследовательской работы:
«Исследование активности импульсного УФ излучения сплошного спектра в отношении биологических плёнок условно-патогенных микроорганизмов»
Цель исследований: Определение условий разрушения биологических пленок грамотрицательных и грамположительных условно-патогенных микроорганизмов на абиотических тест-объектах радиационными потоками импульсного ультрафиолетового излучения сплошного спектра.
Задачи исследований:
-
Экспериментально подтвердить возможность эффективного разрушения биопленок на поверхности с помощью импульсного УФ излучения сплошного спектра.
-
Определить требуемые для разрушения биопленок энергетические дозы УФ излучения сплошного спектра.
-
Определить условия применения импульсных УФ установок для разрушения биопленок и эффективной инактивации микроорганизмов.
Материалы и методы исследования
Место проведения исследований. ФБУН Центральный НИИ эпидемиологии Роспотребнадзора. Исследования выполнены в соответствии с договором № 20/17 от 26 декабря 2017 г. Сроки проведения: январь 2018 г. - август 2018 г.
Оборудование: Исследования проводились на лабораторном макете установки, представляющим собой закрытый бокс (размеры), внутри которого располагались: импульсная ксеноновая лампа (Рисунок 1) и облучаемые тест-объекты.
Импульсная ксеноновая лампа располагается на высоте 20 см от держателя, обеспечивающего точное позиционирование с испытуемыми тест-объектами относительно источника излучения. Для предотвращения возмоного повышенного нагрева тест-объектов при длительном их облучении в боковых стенках корпуса бокса были расположены вентиляторы. Блок питания и управления импульсной ксеноновой лампы был реализован в отдельном корпусе на основе серийной импульсной УФ установки «Альфа-05».

Рисунок 1 - Лабораторный макет установки
1 – импульсная ксеноновая лампа
Источником ультрафиолетового излучения сплошного спектра являлась импульсная ксеноновая лампа трубчатого типа, с внутренним диаметром кварцевой колбы 5 мм и межэлектродным расстоянием 120 мм. Средняя электрическая мощность лампы составляла 200 Вт и генерировала вспышки света с частотой 3,3 Гц. Спектр излучения (рисунок 2) сплошной с наложением одиночных линий, а спектральное распределение энергии излучение соответствуют излучателю черного тела с температурой 8 000К.
Радиационные характеристики ксеноновой лампы измерялись по методике взаимной калибровки между калиброванным фотоприемником UV Sensor «TOCON-probe», регистрирующим излучение в диапазоне от 220 до 275 нм с максимумом чувствительности на 255 нм и оптоволоконным спектрометром просветленного типа с высокой чувствительностью в ультрафиолетовом диапазоне AvaSpec-ULS2048-USB2.
Измерительные приборы устанавливались напротив оси лампы на расстоянии 250 см. Регистрируемый сигнал со спектрометра выводился на ноутбук со специальным программным обеспечением «Avantes», сигнал с датчика UV Sensor «TOCON-probe» выводился на пишущий цифровой осциллограф TDS-2004С.
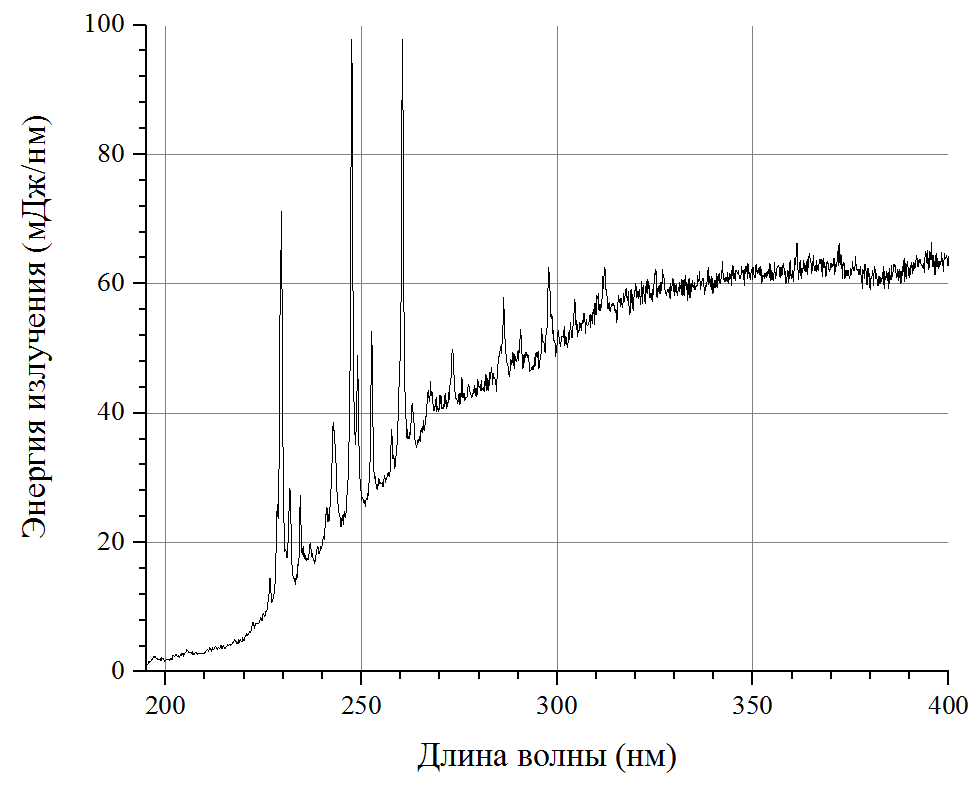
Рисунок 2 - Спектр излучения импульсной ксеноновой лампы
Интегрирование полученного спектра излучения позволяет получить энергию излучения лампы в необходимом спектральном диапазоне:
-
200-230 нм – 0,2 Дж;
-
200-300 нм – 2,8 Дж;
-
200-400 нм – 8,8 Дж.
Распределение дозы на поверхности чашки Петри рассчитывалось по стандартной методике (Григорьев Б.А. Импульсный нагрев излучениями. Москва: Наука, 1974).
Результаты расчетов по вышеприведенной методике представлены в таблице 1.
Таблица 1. Облученность поверхности тест-объекта импульсной ксеноновой лампой.
|
λ, нм |
Энергия излучения за 1 импульс, Дж |
Расстояние от поверхности раствора до оси источника, см |
Доза за 1 импульс, мДж/см2 |
|
200-230 |
0,2 |
20 |
0,048 |
|
200-300 |
2,8 |
0,67 |
|
|
200-400 |
8,8 |
2,1 |
В качестве тест-объектов использовали биологические пленки, образованные штаммами Pseudomonas aeruginosa АТСС 15442 и Staphylococcus aureus 906.
Тест-поверхности: металлические пластины размером 10х10 мм, изготовленные из нержавеющей стали.
Методика исследования эффективности УФ установки в отношении деструкции биологических пленок.
Биопленки получали методом культивирования (выращивания) суточных культур, исследуемых в данной работе штаммов, разведенных до концентрации 0,5 Ед по McFarland, на стерильных металлических пластинах 10х10 мм, погруженных в чашку Петри с 15 мл ЛБ, при 370С на термокачалке (Pseudomonas aeruginosa – 24 ч., Staphylococcus aureus – 48 ч).
Пластины с образовавшимися биологическими пленками помещали в одноразовую чашку Петри и последовательно облучали сначала одну сторону пластины, потом образец переворачивали и повторяли цикл УФ воздействия. Облучение проводили в изолированном боксе описанным выше. Тест-объект (металлическая пластина с биопленкой) располагался по центру под источником излучения (рисунок 1). Расстояние до источника излучения 20 см. Взаимное расположение источника излучения и образцов во время облучения оставалось неизменным, как при проведении отдельного опыта, так и в разных опытах.
Инкубирование облученных тест-объектов проводили в чашках Петри в 15 мл ЛБ и 15 мл ЛА при 370С, 24ч и 48ч, для разных штаммов соответственно. После инкубации бульон с планктонной культурой удаляли, чашки Петри с пластинами промывали дистиллированной водой. Затем половину образцов биопленки элюировали с тест-поверхности 0,1% спиртовым раствором генциана фиолетового и определяли оптическую плотность полученного окрашенного раствора на фотометре Multiskan FC при длине волны 492 нм. По разнице оптической плотности окрашенных растворов элюированных биопленок, подвергшихся и не подвергшихся облучению, судили об эффективности деструктивного действия высокоинтенсивного УФ-излучения сплошного спектра, генерируемого импульсной ксеноновой лампой, в отношении биопленок грамположительных и грамотрицательных микроорганизмов при заданном времени облучения.
Другую половину биопленок снимали с тест-поверхности путем инкубации тест-объекта на мешалке типа «Вортекс» в пробирках с дистиллированной водой и стеклянными бусами при комнатной температуре в течение 2 минут, далее, содержимое пробирки высевали глубинным методом на плотную питательную среду ЛА и через 24 - 72 часа проводили подсчет жизнеспособных клеток (КОЕх10n).
Этапы исследования.
Исследование состояло из нескольких последовательно осуществленных несвязанных между собой этапов:
1 этап. Экспериментальное подтверждение возможности эффективного разрушения биопленок на поверхности с помощью импульсного УФ излучения сплошного спектра и определения требуемой для разрушения биопленок энергетические дозы импульсного УФ излучения сплошного спектра. Последовательность выполнения: культивирование (выращивание) биологических пленок на металлических пластинках и последующее их облучение импульсной УФ-установкой во временном интервале от 1 минуты до 32 минут (1,2,4,8,16,20,24,28,32 минуты).
2 и 3 этапы проводились с целью определения условий применения импульсных УФ установок для эффективной инактивации штамма Pseudomonas aeruginosa АТСС 15442 и деструкции биопленок.
2 этап. Последовательность выполнения: а) культивирование (выращивание) биологических пленок штамма Pseudomonas aeruginosa АТСС 15442 на металлических пластинках; б) воздействие на тест-поверхности 0,5% рабочим раствором дезинфицирующего средства, содержащим третичный амин, ингибиторы коррозии, поверхностно активные вещества, в течении 30 минут в соответствии с режимами, рекомендованными в инструкции по применению для обработки поверхностей); в) дальнейшее облучение тест-поверхностей импульсной УФ-установкой во временном интервале от 1 минуты до 5 минут (1,2,3,4,5 минут).
3 этап. Последовательность выполнения: а) культивирование (выращивание) биологических пленок штамма Pseudomonas aeruginosa АТСС 15442 на металлических пластинках; б) облучение тест-поверхностей импульсной УФ-установкой во временном интервале от 1 минуты до 5 минут (1,2,3,4,5 минут); в) последующая обработка тест-поверхностей 0,5% рабочим раствором дезинфицирующего средства, содержащим третичный амин, ингибиторы коррозии, поверхностно активные вещества, в течении 30 минут в соответствии с режимами, рекомендованными в инструкции по применению для обработки поверхностей.
В качестве контрольных групп служили интактные тест-поверхности с отсутствием тест-культуры (холостая группа), облучения ее импульсным УФ излучением сплошного спектра (Контроль 1), обработанные в течении 30 мин дезинфицирующим средством (Контроль 2).
Полученные результаты
Бактерицидная активность импульсного УФ излучения сплошного спектра в отношении 2 видов биопленок коллекционных штаммов представлена в таблицах 2 и 3. Деструкцию биопленок наблюдали уже после 1 минуты воздействия импульсного УФ излучения сплошного спектра. При возрастании экспозиции облучения значения оптической плотности растворенной биопленки статистически достоверно не менялось. Возможно, за первую минуту облучения в результате поглощения излучения происходят все значимые фотохимические превращения, влияющие на оптическую плотность»
Таблица 2. Динамика оптической плотности биопленки коллекционного штамма Pseudomonas aeruginosa АТСС 15442 при воздействии импульсного УФ излучения сплошного спектра в различные временные интервалы
|
Холостая проба (пластины без культуры) |
Контроль 1 (образец без облучения) |
Время воздействия импульсной УФ-установки, мин |
||||||
|
1
|
2
|
4
|
8
|
16
|
||||
|
0,040± 0,0005 |
0,113± 0,004 |
0,083 0,001* |
0,080± 0,002* |
0,089± 0,004* |
0,085± 0,002* |
0,086± 0,003* |
||
|
Время воздействия импульсной УФ-установки, мин |
||||||||
|
20 |
24 |
28 |
32 |
|||||
|
0,084±0,002* |
0,080±0,005* |
0,083±0,003* |
0,072±0,003* |
|||||
Примечание: данные представлены в единицах оптической плотности окрашенного раствора элюированных биологических пленок, измеренной при длине волны 492 нм.
* - p<0,05 по сравнению с контролем; M±m, n (количество повторов) =36.
Таблица 3. Динамика оптической плотности биопленки коллекционного штамма Staphylococcus aureus (штамм 906) при воздействии импульсного УФ излучения сплошного спектра в различные временные интервалы
|
Холостая проба (пластины без культуры) |
Контроль 1 (образец без облучения) |
Время воздействия импульсной УФ-установки, мин |
||||||
|
1 |
2 |
4 |
8 |
16 |
||||
|
0,040± 0,0004 |
0,087± 0,003 |
0,076± 0,001* |
0,085± 0,002 |
0,085± 0,003 |
0,085± 0,002 |
0,075± 0,002* |
||
|
Время воздействия импульсной УФ-установки, мин |
||||||||
|
20 |
24 |
28 |
32 |
|||||
|
0,070±0,003* |
0,071±0,003* |
0,070±0,003* |
0,076±0,003* |
|||||
Примечание: данные представлены в единицах оптической плотности окрашенного раствора элюированных биологических пленок, измеренной при длине волны 492 нм.
* - p<0,05 по сравнению с контролем; M±m, n (количество повторов) =36.
В ходе экспериментов не было обнаружено существенного изменения экстинкции в зависимости от времени воздействия потоками импульсного УФ излучения, поэтому увеличение времени экспозиции в интервале времени более 30 минут считали нецелесообразным. Минимальное время воздействия импульсного УФ излучения на биопленку, вызывающее ее деструкцию, составило 1 минуту.
При этом инактивация обоих тест-штаммов, в отличие от деструктивных процессов, достоверно наступала уже после 1 минуты облучения, полностью исчезая в экспериментальных группах, начиная с 2 минуты воздействия импульсной УФ-установки (Таблицы 4 и 5).
Таблица 4. Динамика роста жизнеспособных бактерий биопленки Pseudomonas aeruginosa АТСС 15442 при воздействии импульсного УФ излучения сплошного спектра в различные временные интервалы
|
Холостая проба (пластины без культуры) |
Контроль 1 (образец без облучения) |
Время воздействия импульсной УФ-установки, мин |
|||||||
|
1
|
2
|
4
|
8
|
16
|
|||||
|
0
|
3,6х105± 9833 |
8,2х103± 953* |
Нет роста |
Нет роста |
Нет роста |
Нет роста |
|||
|
Время воздействия импульсной УФ-установки, мин |
|||||||||
|
20 |
24 |
28 |
32 |
||||||
|
Нет роста |
Нет роста |
Нет роста |
Нет роста |
||||||
Примечание: Данные представлены в количестве колониеобразующих единиц (КОЕ).
* - p<0,05 по сравнению с контролем; M±m, n (количество повторов) =4.
Таблица 5. Динамика роста жизнеспособных бактерий биопленки Staphylococcus aureus (штамм 906) при воздействии импульсного УФ излучения сплошного спектра в различные временные интервалы
|
Холостая проба (пластины без культуры) |
Контроль 1 (образец без облучения) |
Время воздействия импульсной УФ-установки, мин |
|||||||
|
1
|
2
|
4
|
8
|
16
|
|||||
|
0
|
1,5х105± 11417 |
2,1х103± 794* |
Нет роста |
Нет роста |
Нет роста |
Нет роста |
|||
|
Время воздействия импульсной УФ-установки, мин |
|||||||||
|
20 |
24 |
28 |
32 |
||||||
|
Нет роста |
Нет роста |
Нет роста |
Нет роста |
||||||
Примечание: Данные представлены в количестве колониеобразующих единиц (КОЕ).
* - p<0,05 по сравнению с контролем; M±m, n (количество повторов) =4.
Результаты опытов свидетельствуют о высокой бактерицидной активности импульсного УФ излучения, прежде всего, на жизнеспособность бактериальных клеток, находящихся в составе биопленок (отсутствие роста бактерий, начиная со 2 минуты облучения).
Результаты исследований на 2 и 3 этапах представлены в таблицах 6 и 7.
Таблица 6. Динамика оптической плотности биопленки коллекционного штамма Pseudomonas aeruginosa АТСС 15442 при воздействии дезинфицирующего средства с последующим облучением тест-поверхностей импульсным УФ излучением сплошного спектра в различные временные интервалы
|
Холостая проба (металл без культуры) |
0,050±0,002 |
|
|
Контроль I (биопленку не подвергали воздействию) |
0,101±0,002 |
|
|
Контроль II (Д/С, 0,5% - 30 мин) |
0,092±0,002* |
|
|
Импульсное УФО, 1 мин |
- |
0,081±0,002*** |
|
Д/С |
0,075±0,003*** |
|
|
Импульсное УФО, 2 мин |
- |
0,100±0,001** |
|
Д/С |
0,080±0,001*** |
|
|
Импульсное УФО, 3 мин |
- |
0,090±0,002** |
|
Д/С |
0,110±0,002*** |
|
|
Импульсное УФО, 4 мин |
- |
0,098±0,003 |
|
Д/С |
0,091±0,003* |
|
|
Импульсное УФО, 5 мин |
- |
0,102±0,003** |
|
Д/С |
0,101±0,004 |
|
Примечание: n (кол-во повторов) = 12; Д/С – дезинфицирующее средство; * - p<0,05 по сравнению с контролем I; ** - p<0,05 по сравнению с контролем II; *** - p<0,05 по сравнению с контролем I и II
Таблица 7. Динамика оптической плотности биопленки коллекционного штамма Pseudomonas aeruginosa АТСС 15442 при облучении тест- поверхностей импульсным УФ излучением сплошного спектра в различные временные интервалы с последующим воздействием дезинфицирующего средства
|
Холостая проба (металл без культуры) |
0,050±0,002 |
|
|
Контроль I (биопленку не подвергали воздействию) |
0,101±0,002 |
|
|
Контроль II (Д/С, 0,5% - 30 мин) |
0,092±0,002* |
|
|
Импульсное УФО, 1 мин |
- |
0,084±0,001*** |
|
Д/С |
0,084±0,001*** |
|
|
Импульсное УФО, 2 мин |
- |
0,094±0,002* |
|
Д/С |
0,066±0,002**** |
|
|
Импульсное УФО, 3 мин |
- |
0,099±0,002** |
|
Д/С |
0,070±0,002**** |
|
|
Импульсное УФО, 4 мин |
- |
0,101±0,003** |
|
Д/С |
0,051±0,002**** |
|
|
Импульсное УФО, 5 мин |
- |
0,099±0,004 |
|
Д/С |
0,050±0,001**** |
|
Примечание: **** - p<0,05 по сравнению с образцом, подвергнутым только воздействию импульсной УФ-установкой.
Примечание: n (кол-во повторов) = 12; Д/С – дезинфицирующее средство; * - p<0,05 по сравнению с контролем I; ** - p<0,05 по сравнению с контролем II; *** - p<0,05 по сравнению с контролем I и II
Результаты исследований на 2 этапе показывают снижение оптической плотности раствора облучаемой импульсным УФ излучением биопленки уже через 1 минуту воздействия, что согласуется с данными, полученными ранее (Табл. 2).
Результаты исследований также показывают, что при предварительной обработке тест-обектов дезинфицирующим средством с последующим их УФ облучением было достигнуто более значимое снижение оптической плотности биопленки по сравнению с обработкой тест-объекта только дезинфицирующим средством.
Результаты исследований на 3 этапе также показали снижение оптической плотности раствора биопленки уже после 1 минуты облучения. Однако, в отличие от схемы экспериментов на 2 этапе, начиная с 4 минут предварительного облучения тест-объекта импульсной ксеноновой лампой, было достигнуто более значимое снижение оптической плотности биопленки (0,051+ 0,02 в сравнении с 098+0,03) (Таблица 7).
Полученные данные свидетельствуют, что высокоинтенсивное импульсное ультрафиолетовое излучение сплошного спектра, генерируемое ксеноновой лампой, вероятно инициировало фотоокислительные процессы в матриксе (гликокаликсе) биологических пленок, вследствие чего произошло снижение барьерных функций матрикса, что, в свою очередь, позволило дезинфицирующему средству напрямую воздействовать на клетки бактерий биопленки в течение всего времени экспозиции.
Заключение
-
Результаты исследований показали, что ультрафиолетовое излучение сплошного спектра, генерируемое импульсной ксеноновой лампой, является высокоэффективной технологией по инактивации штаммов Staphylococcus aureus (штамм 906) и Pseudomonas aeruginosa (штамм АТСС 15442), входящих в состав биологической пленки, и деструкции матрикса биологической пленки. При этом 100% инактивация штаммов исследованных бактерий наступала раньше и не зависела от процесса деструкции биологических пленок.
-
Определена минимальная энергетическая доза импульсного ультрафиолетового излучения сплошного спектра, обеспечивающая полную (100%) инактивацию бактериальных клеток при исходной контаминации 105 КОЕ, которая составляет 0,25 Дж/см2 в спектральном диапазоне 200 – 300 нм.
-
Использование импульсного ультрафиолетового излучения сплошного спектра с энергетической дозой 0,5 Дж/см2 с последующей обработкой тест-поверхностей комплексным химическим дезинфицирующим средством в соответствии с инструкцией по применению приводит к полному разрушению биопленки и 100% инактивации входящих в ее состав бактериальных клеток.
Практические рекомендации
При проведении в помещениях медицинских организаций дезинфекционных мероприятий по обеззараживанию на поверхностях бактериальных биологических пленок рекомендуется применение импульсных ультрафиолетовых установок, позволяющих одновременно снижать барьерные свойства биологических пленок и с высокой эффективностью инактивировать входящие в их состав бактерии.
Для усиления эффективности удаления с поверхностей помещений биологических пленок с помощью химических дезинфекционных средств рекомендуется использовать следующий алгоритм их обработки: вначале поверхности облучаются импульсными ультрафиолетовыми установками, обеспечивающими инактивацию бактерий в дозе не менее 0,5 Дж/см2, затем проводится их повторная обработка химическими дезинфицирующими средствами по режимам, эффективным в отношении объектов, загрязненных биологическим материалом.
Читайте также про эффективность установки «Yanex-5» против синегнойной палочки (P. aeruginosa), клебсиелла пневмонии (K. pneumoniae), клостридий (C. difficile), Acinetobacter baumannii