










Сергей Киреев2, Сергей Шашковский1, Татьяна Гренкова3, Яков Гольдштейн2, Игорь Гончаренко2, Евгения Селькова3
- Государственное образовательное учреждение высшего профессионального обучения «Московский государственный технический университет имени Н.Э. Баумана», Россия
- Общество с ограниченной ответственностью «Научно-производственное предприятие «Мелитта», Россия, 117997, Москва, ул. Миклухо-Маклая, д.16/10
- Федеральное бюджетное учреждение науки "Московский научно-исследовательский институт эпидемиологии и микробиологии им. Г.Н.Габричевского", Россия 125212, г. Москва, улица Адмирала Макарова, дом 10.
Abstract
В работе представлены результаты исследования эффективности импульсного ультрафиолетового излучения сплошного спектра в отношении клинических штаммов бактерий с высоким эпидемическим потенциалом, широкой лекарственной устойчивостью и устойчивостью к основным группам химических средств дезинфекции (MRSA, VRE, Ac.baumannii, P.aeruginosa, Proteus mirabilis, St. aureus). Исходная контаминация пластмассовых и металлических тест-объектов составляла не менее 107 КОЕ/см2. Исследуемые образцы располагались на расстоянии от 1,2 до 2 м в горизонтальном и вертикальном положениях и облучались в течение 5, 10, 20 мин. После 5 минут облучения снижение уровня обсемененности составило не менее 4,9 lg для всех микроорганизмов и поверхностей. Загрязнение тест-объектов белковой нагрузкой не влияло на эффективность обеззараживания. Эффективность деконтаминации при использовании металлических пластин снижалась незначительно.
Ключевые слова: MRSA, VRE, обеззараживание, клинические штаммы бактерий, множественная лекарственная устойчивость, эффективность, pulsed light, ultraviolet.
Introduction
В последние десятилетия большое внимание уделяется разработке мероприятий по профилактике инфекций, связанных с оказанием медицинской помощи (ИСМП), вызванных клиническими штаммами бактерий, обладающими множественной лекарственной устойчивостью и устойчивостью к различным группам химических средств дезинфекции. Актуальные возбудители ВБИ - Methicillin-resistant Staphylococcus aureus (MRSA) и Vancomycin Resistant Enterococcus (VRE) могут вызывать разнообразные клинические формы инфекций: пневмонию, бактеремию, инфекцию мочевыводящих путей, менингит, остеомиелит и др. Согласно современным данным [1] в Европе MRSA вызывает 170 000 инфекций в год, около 5 тысяч из которых приводят к летальному исходу. Затраты на обслуживание пациентов, подвергшихся инфицированию MRSA, составляют около 380 миллионов евро в год. Аналогичные затраты в США составляют около 9,7 миллиардов долларов в год [2]. Частота выявления ИСМП, вызванных VRE, в европейских странах составляет до 40% [3] в зависимости от страны и методов предупреждения инфекций, принятых в медицинских учреждениях.
Одной из распространенных мер профилактики ИСМП является ручная очистка и дезинфекция поверхностей помещений и объектов госпитальной среды растворами химических средств. Однако данный способ дезинфекции имеет ряд существенных недостатков [4]: невозможность обработать труднодоступные места, в том числе места выше человеческого роста, сильная зависимость эффективности обеззараживания поверхностей от четкого соблюдения персоналом инструкции по приготовлению и применению рабочего раствора дезинфицирующего средства, зависимость эффективности обеззараживания от времени контакта дезинфицирующего средства с поверхностью, трудоемкость дезинфицирующих мероприятий.
В настоящее время для обеззараживания воздуха и поверхностей помещений и объектов госпитальной среды применяют новый метод, основанный облучении объекта высокоинтенсивным импульсом излучения сплошного спектра, формирующимся в ксеноновом газовом промежутке при приложении к нему высокого напряжения. [5-7].
На данный момент существует обширная база микробиологических и клинических исследований, свидетельствующих о высокой эффективности метода, но, в тоже время, отсутствует экспериментальная база бактерицидных доз, требуемых для обеззараживания воздуха и поверхностей от микрофлоры госпитальной среды [5-7].
Работа направлена на определение бактериальных доз УФ излучения сплошного спектра и необходимых условий обеззараживания помещений с эффективностью более 99,9% от актуальных возбудителей ИСМП.
Material and methods
Бактериальные штаммы
Объектами исследований послужили тестовый штамм 907 S. aureus и клинические устойчивые к широкому спектру антибиотиков штаммы бактерий: P. aeruginosa, MRSA, Enterococcus faecium (VRE) , Acinetobacter baumannii, а так же эпидемический штамм Pr. mirabilis. Выбранные клинические штаммы микроорганизмов были изучены на предмет устойчивости к средствам химической дезинфекции из разных групп. Для контроля эффективности режимов дезинфекции использовали тест-штаммы E coli 1257 и S. aureus 907. Проведенные исследования выявили устойчивость неферментирующих энтеробактерий (P. aeruginosa и Acinetobacter baumannii) к дезинфицирующим средствам из всех тестируемых групп.
Суточную взвесь культуры госпитального или тест-штамма готовили по отраслевому стандартному образцу мутности №20 (9lg) на физиологическом растворе и физиологическом растворе с 40% сывороткой крови барана (6 мл. раствора и 4 мл сыворотки). Для выращивания культур использовали кровяной агар. При помощи микропипетки наносили 0.02 мл микробной взвеси на дно стерильной пластиковой чашки Петри или металлическую пластину той же площади. Микрокапли равномерно растирали по поверхности тест-объекта и подсушивали. Испытания проводили не позднее 1 часа после нанесения микрокапель с тест-микроорганизмами.
После воздействия на микробную взвесь, нанесенную на дно чашки Петри, ультрафиолетового излучения в чашку заливали 10 мл стерильного физиологического раствора, тщательно размешивая круговыми движениями, затем добавляли 10 мл расплавленной и остуженной до 45оС плотной питательной среды, закрывали крышками и давали застыть до плотной консистенции. Данная методика является точной, так как позволяет учитывать даже единичные жизнеспособные колонии.
Культуру с металлического тест-объекта после воздействия излучения смывали на стерильную салфетку, которую отбивали в колбе с бусами в 10мл. стерильного физиологического раствора. По 0,1 мл полученной взвеси засевали на плотные селективные питательные среды.
Источник УФ излучения
Источником УФ излучения была импульсная ксеноновая лампа установки «Yanex-2». Электрическая мощность лампы составляла 1000 Вт.
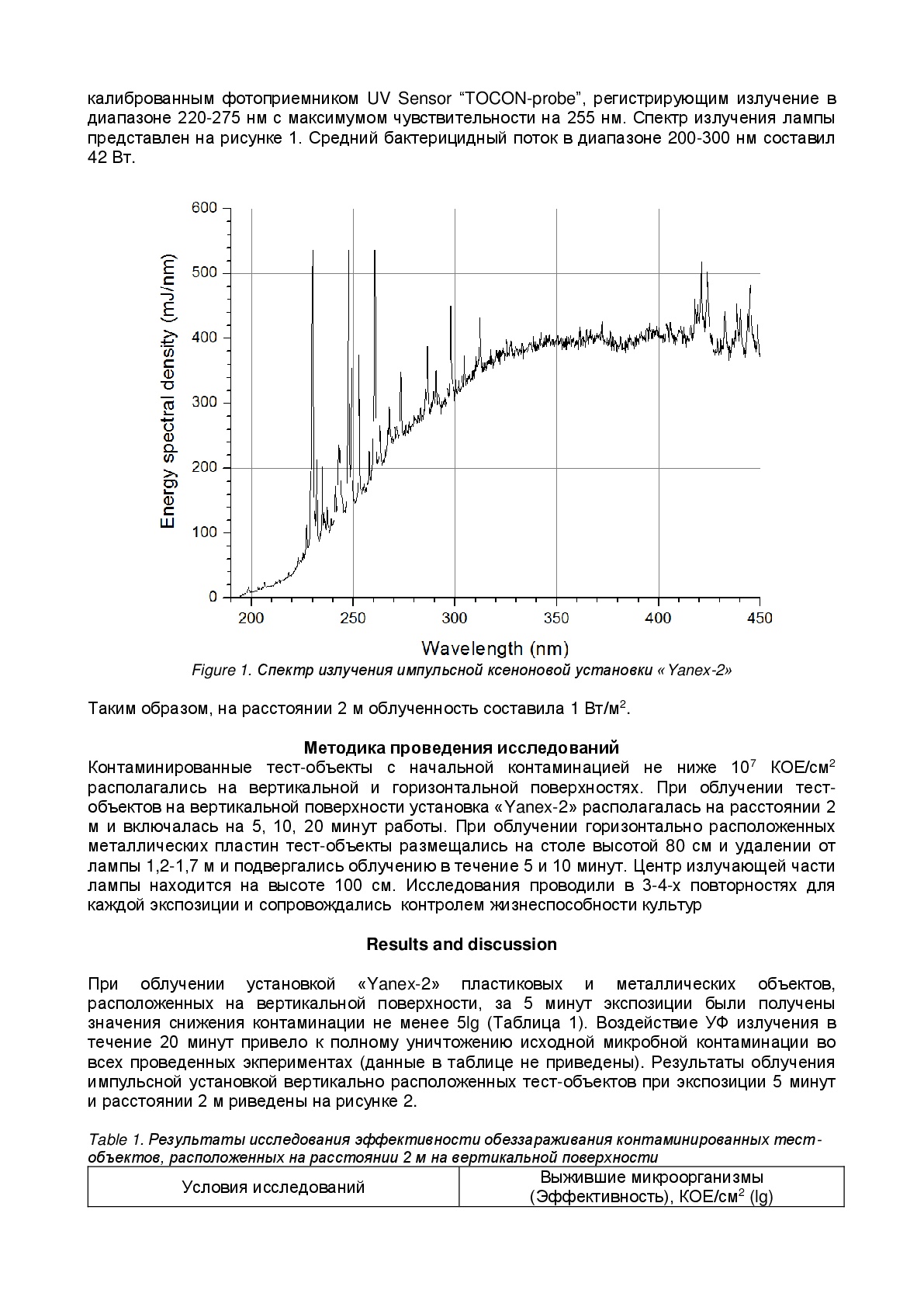
Импульсная ксеноновая лампа имела U-образную форму и генерировала мощные световые вспышки длительностью на полувысоте 120 мкс с частотой 2,5 Гц. УФ излучение в диапазоне 200-400 нм регистрировалось с помощью оптоволоконного спектрометра просветленного типа с высокой чувствительностью в ультрафиолетовом диапазоне AvaSpec-ULS2048-USB2. Радиационные характеристики лампы контролировались калиброванным фотоприемником UV Sensor “TOCON-probe”, регистрирующим излучение в диапазоне 220-275 нм с максимумом чувствительности на 255 нм. Спектр излучения лампы представлен на рисунке 1. Средний бактерицидный поток в диапазоне 200-300 нм составил 42 Вт.
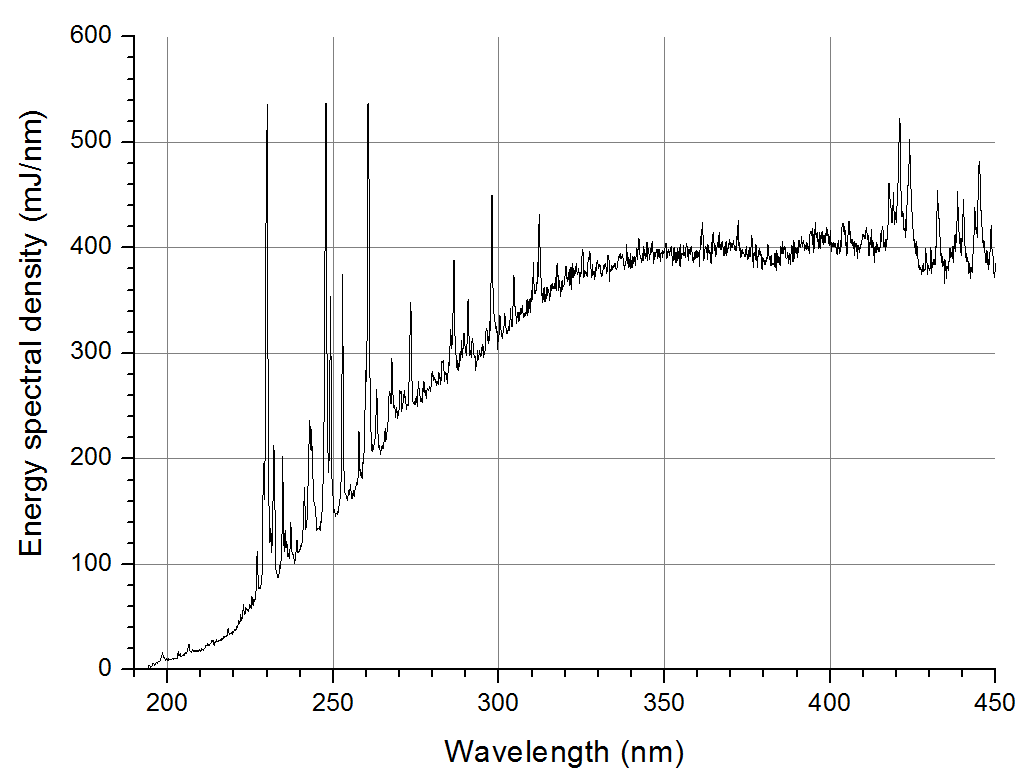
Таким образом, на расстоянии 2 м облученность составила 1 Вт/м2.
Методика проведения исследований
Контаминированные тест-объекты с начальной контаминацией не ниже 107 КОЕ/см2 располагались на вертикальной и горизонтальной поверхностях. При облучении тест-объектов на вертикальной поверхности установка «Yanex-2» располагалась на расстоянии 2 м и включалась на 5, 10, 20 минут работы. При облучении горизонтально расположенных металлических пластин тест-объекты размещались на столе высотой 80 см и удалении от лампы 1,2-1,7 м и подвергались облучению в течение 5 и 10 минут. Центр излучающей части лампы находится на высоте 100 см. Исследования проводили в 3-4-х повторностях для каждой экспозиции и сопровождались контролем жизнеспособности культур.
Results and discussion
При облучении установкой «Yanex-2» пластиковых и металлических объектов, расположенных на вертикальной поверхности, за 5 минут экспозиции были получены значения снижения контаминации не менее 5lg (Таблица 1). Воздействие УФ излучения в течение 20 минут привело к полному уничтожению исходной микробной контаминации во всех проведенных экпериментах (данные в таблице не приведены). Результаты облучения импульсной установкой вертикально расположенных тест-объектов при экспозиции 5 минут и расстоянии 2 м риведены на рисунке 2.
Table 1. Результаты исследования эффективности обеззараживания контаминированных тест-объектов, расположенных на расстоянии 2 м на вертикальной поверхности.
| Условия исследований | Выжившие микроорганизмы (Эффективность), КОЕ/см2 (lg) | ||
| 0 минут | 5 минут (336 Дж/м2) | 10 минут (672 Дж/м2) | |
| MRSA | |||
| Чашка Петри без белковой нагрузки | 5х108 | 28 (7.2) | 0 (8.7) |
| Чашка Петри с белковой нагрузкой | 50 (7) | 1 (8.7) | |
| Металлические пластины без белковой нагрузки | 67 (6.8) | - | |
| Металлические пластины с белковой нагрузки | 1.83 х103 (5.4) | - | |
| VRE | |||
| Чашка Петри без белковой нагрузки | 1.9х107 | 21 (5.9) | 15 (6.1) |
| Чашка Петри с белковой нагрузкой | 2.3х107 | 19 (6) | 20 (6) |
| Металлические пластины без белковой нагрузки | 1.83х107 | 910 (4.3) | 440 (4.6) |
| Металлические пластины с белковой нагрузки | 600 (4.4) | 610 (4.4) | |
| P.aeruginosa | |||
| Чашка Петри без белковой нагрузки | 1.65х107 | 16 (6) | 1 (7.2) |
| Чашка Петри с белковой нагрузкой | 9 (6.2) | 1 (7.2) | |
| Металлические пластины без белковой нагрузки | 1.5х107 | 100 (5.1) | 25 (5.7) |
| Pr.mirabilis | |||
| Чашка Петри без белковой нагрузки | 5х108 | 6 (7.9) | - |
| Чашка Петри с белковой нагрузкой | 2 (8.3) | - | |
| Металлические пластины без белковой нагрузки | 6х107 | 730 (5.9) | - |
| Металлические пластины с белковой нагрузки | 730 (5.9) | - | |
| Ac.baumanni | |||
| Чашка Петри без белковой нагрузки | 2.32х107 | 20 (6) | 15 (6.1) |
| Чашка Петри с белковой нагрузкой | 35 (5.6) | 27 (5.7) | |
| St.aureus | |||
| Чашка Петри без белковой нагрузки | 7х108 | 32 (7.3) | - |
| Чашка Петри с белковой нагрузкой | 48 (7.1) | 0 (8.8) | |
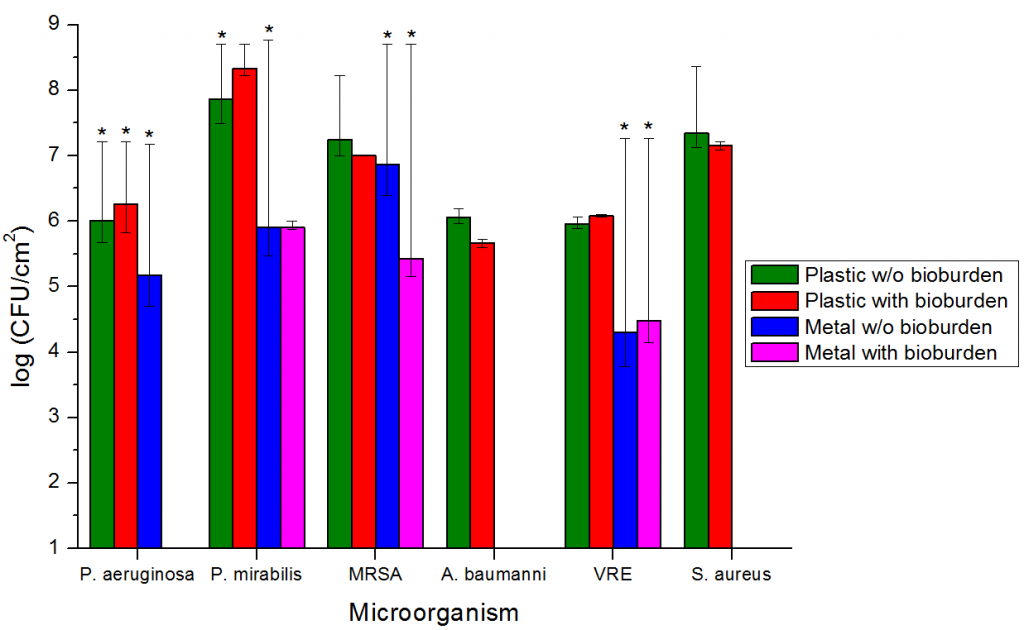
Figure 2. Эффективность обеззараживания импульсным излучением сплошного спектра контаминированных образцов с белковой защитой (б/з) и без нее. * - показывает 100%-ную деконтаминацию как минимум одного из тест-объектов.
Облучение горизонтально расположенных металлических объектов обеспечило эффективность обеззараживания 4,9-7,6 lg, в зависимости от бактериального штамма и расстояния до источника излучения (таблица 2).
Table 2. Результаты исследования эффективности обеззараживания горизонтально расположенных металлических пластин, контаминированных клиническими штаммами микроорганизмов.
| Среднее расстояние до тест-объекта, м | Наличие биологической нагрузки | Время облучения (Доза), мин (Дж/м2) | Контроль, КОЕ/см2 | Выжившие микроорганизмы (Эффективность), КОЕ/см2 (lg) |
| MRSA | ||||
| 1,6 | без нагрузки | 5 (62,6) | 1,15 х107 | 100 (5) |
| 1,7 | с нагрузкой | 5 (52,5) | 1,4 х107 | 160 (4,9) |
| 1,4 | без нагрузки | 10 (184) | 1,15 х107 | 100 (5) |
| 1,5 | с нагрузкой | 10 (151) | 1,4 х107 | 83 (5,2) |
| P.aeruginosa | ||||
| 1,4 | без нагрузки | 5 (92) | 4,6 х107 | 0 (7,6) |
| 1,5 | с нагрузкой | 5 (75,5) | 4,7 х107 | 33 (6,1) |
| 1,2 | без нагрузки | 10 (286) | 4,6 х107 | 0 (7,6) |
| 1,3 | с нагрузкой | 10 (228) | 4,7 х107 | 0 (7,6) |
Вне зависимости от ориентации объектов относительно источника излучения эффективность обеззараживания практически не зависит от присутствия биологической нагрузки и слабо зависит от типа материала поверхности. Сравнение с установками на основе ртутьсодержащих ламп показывает значительно большую эффективность обеззараживания импульсного источника излучения при одинаковых дозах [8-10]. Так, обеззараживание объектов, контаминированных S. aureus с белковой нагрузкой, с эффективностью 99,9% потребует дозы не более 32 Дж/м2 импульсной ксеноновой лампы и более 1500 Дж/м2 ртутной лампы [9]. Деконтаминация части тест-объектов со 100%-ной эффективностью (рисунок 2) говорит об отсутствии эффекта достижения максимума эффективности, характерного для источников излучения на основе ртути. Этот эффект выражается в отсутствии увеличения эффективности обеззараживания после снижения начального уровня обсемененности на 2-4 порядка даже при 10-кратном увеличении дозы [9, 10].
Достигнутые в работе высокие значения эффективностей обеззараживания различных объектов, контаминированных клиническими штаммами микроорганизмов с высоким эпидемическим потенциалом, обусловлены одновременным воздействием УФ излучения широкого спектрального состава практически на все структуры клетки. Такое многоканальное воздействие на клетку обеспечивает резкое снижение бактерицидных доз [11-22]. Репарационные процессы при этом либо протекают с значительно меньшей скоростью [23], либо отсутствуют полностью [15, 24]. Исследования воздействия импульсного излучения сплошного спектра на мембрану клетки показывают ее разрушение с потерей барьерной и регуляторной функций и вытеканием цитоплазмы [25, 26].
Conclusions
Проведенные исследования показали высокую бактерицидную эффективность импульсного ультрафиолетового излучения сплошного спектра в отношении клинических штаммов, обладающих множественной лекарственной устойчивостью и устойчивостью к различным группам химических средств дезинфекции. Эффективность обеззараживания как грамположительных, так и грамотрицательных микроорганизмов слабо зависит от присутствия биологической нагрузки и составляет 4-8 log. Тип материала облучаемой поверхности незначительно влияет на эффективность обеззараживания. Сравнительные исследования, проведенные с тестовым и клиническим штаммами S. aureus(907) и MRSA, показали идентичные значения эффективности обеззараживания образцов ≈ 7-7,5 lg. Полученные пороговые бактерицидные дозы значительно ниже аналогичных значений для ртутных бактерицидных облучателей, что позволяет значительно сократить время проведения дезинфекционных процедур мероприятий. Результаты экспериментальных исследований позволяют утверждать, что установка «Yanex-2» является высокоэффективным и простым в эксплуатации устройством экспресс обеззараживания поверхностей помещений и объектов больничной среды.
References
- Köck R., Becker K., Cookson B. et al., Methicillin¬resistant Staphylococcus aureus (MRSA): burden of disease and control challenges in Europe, Euro Surveill, 15 (41), (2010).
- Mark Stibich, Julie Stachowiak et. al, Evaluation of a pulsed-xenon ultraviolet room disinfection device for impact on hospital operations and microbial reduction, Infection control and hospital epidemiology, vol. 32, no. 3, (march 2011).
- G Werner, T.M. Coque, A.M. Hammerum, R. Hope, W. Hryniewicz, A. Johnson et al., Emergence and spread of vancomycin resistance among enterococci in europe, Eurosurveillance, Volume 13 (47), (2008).
- Otter JA, Yezli S, Perl TM, Barbut F, French GL, The role of ‘no-touch’ automated room disinfection systems in infection prevention and control, Journal of Hospital Infection, 83, pages 1–13 (2013).
- С.Г. Шашковский, Т.А. Калинчук, Н.А. Поликарпов, Я.А. Гольдштейн, И.В. Гончаренко, Оборудование для обеззараживания помещений в ЛПУ на основе импульсной ультрафиолетовой технологии, Поликлиника, №3, pages 42-46 (2009).
- Chetan Jinadatha, Ricardo Quezada, Thomas W Huber et al., Evaluation of a pulsed-xenon ultraviolet room disinfection device for impact on contamination levels of methicillin-resistant Staphylococcus aureus. BMC Infectious Diseases, 14:187 (2014).
- Chan-Ick Cheigh, Mi-Hyun Park, Myong-Soo Chung, Jung-Kue Shin, Young-Seo Park, Comparison of intense pulsed light- and ultraviolet (UVC)-induced cell damage in Listeria monocytogenes and Escherichia coli O157:H7, Food Control, 25, pages 654-659 (2012).
- Anderson DJ, Gergen MF, Smathers E., Sexton DJ., et al, Decontamination of Targeted Pathogens from Patient Rooms Using an Automated Ultraviolet-C-Emitting Device, Infection Control and Hospital Epidemiology, vol. (34), No 5, pp. 466-471 (2013).
- А.И. Васильев, С.В. Костюченко и др. Применение УФ-излучения с целью уменьшения риска заражения внутрибольничными инфекциями, Медицинский алфавит, Эпидемиология и гигиена №2. С. 50-54 (2014)
- Marie U. Owens, David R. Deal, Michael O. Shoemaker et al., High-Dose Ultraviolet C Light Inactivates Spores of Bacillus Atrophaeus and Bacillus Anthracis Sterne on Nonreflective Surfaces, Applied Biosafety, 10(4). Pp. 240-247 (2005).
- Kowalski W., Ultraviolet Germicidal Irradiation Handbook. UVGI for Air and Surface Disinfection, New York.: Springer, 501 p. (2009).
- Varghese A.J., 5-thyminyl-5,6-dihydrothymine from DNA irradiated with ultraviolet light, Biochemical and biophysical research communications, Volume 38, N 3, p. 484-490 (1970).
- Рубин А.Б., Биофизика. Том 2. Биофизика клеточных процессов, p. 464 (1997).
- Munataka N., Rupert C.S., Dark repair of DNA containing “Spore photoproduct” in Bacillus subtilis, Molecular and General Genetics, vol. 130, Issue 3, pp. 239-250 (1974).
- Zimmer J.L., Slawson R.M., Potential Repair of Escherichia coli DNA following Exposure to UV Radiation from Both Medium and Low-Pressure UV Sources Used in Drinking Water Treatment, Applied and Environmental Microbiology, vol. (68), No 7, pp. 3293-3299 (2002).
- Fajardo-Cavazos P, Nicholson W.L., Molecular dissection of mutations in the Bacillus subtilis spore photoproduct lyase gene which affect repair of spore DNA damage caused by UV radiation, Journal of Bacteriology, vol. (177), No 15, pp. 4402-4409 (1995).
- Chen R.Z., Stephen A.C., James R.B., Comparison of the action spectra and relative DNA absorbance spectra of microorganisms: Information important for the determination of germicidal fluence (UV dose) in an ultraviolet disinfection of water, Water research, vol. (43), issue 20, pp. 5087-5096 (2009).
- Nerandzic M.M., Cadnum J.L., Eckart K.E., Donskey C.J., Evaluation of a hand-held far-ultraviolet radiation device for decontamination of Clostridium difficile and other healthcare-associated pathogens, BMC Infectious Diseases, 12:120 (2012).
- Владимиров Ю.А. Физико-химические основы фотобиологических процессов. p. 285 (1983)
- Vermeulen N, Keeler WJ, Nandakumar K, Leung KT., The bactericidal effect of ultraviolet and visible light on Escherichia coli, Biotechnology and Bioengineering, vol. (99), No 3, pp. 550-556 (2008).
- Tyrell RM., Induction of pyrimidine dimers in bacterial dna by 365 nm radiation, Photochemistry and Photobiology, vol. (17), pp. 69-73 (1973).
- Beer JZ, Olvey KM, Miller SA, Thomas DP, Godar DE, Non-nuclear damage and cell lysis are induced by UVA, but not UVB or UVC, radiation in three strains of L5178Y cells, Photochemistry and Photobiology, vol. (58), No5, pp. 676-681 (1993).
- Gomez-Lopez V.M., Ragaert P., Debevere J., Devlieghere F., Pulsed light for food decontamination: a review, Trends in Food Science & Technology, vol. (18), pp. 464-473 (2007).
- Guillou, S., Leroi, F., Orange, N., Bakhrouf, A., Federighi, M., Elmnasser, N., Pulsed-light system as a novel food decontamination technology: a review, Canadian Journal of Microbiology, vol. 53, Issue 7, pp. 813-821 (2007).
- Chan-Ick Cheigh, Mi-Hyun Park, Myong-Soo Chung, Jung-Kue Shin, Young-Seo Park, Comparison of intense pulsed light- and ultraviolet (UVC)-induced cell damage in Listeria monocytogenes and Escherichia coli O157:H7, Food Control, vol. (25), No 2, pp. 654–659 (2012).
- Takeshita K, Shibatoa J., Sameshimaa T, Fukunagab S., Isobec S, Ariharad K., Itoh M., Damage of yeast cells induced by pulsed light irradiation, International Journal of Food Microbiology, vol. (85), Issue 1-2, pp. 151-158 (2003).
Киреев С.Г., Шашковский С.Г., Гренкова Т.А., Гольдштейн Я.А., Гончаренко И.В., Селькова Е.П., Исследование эффективности воздействия импульсным ультрафиолетовым излучением сплошного спектра на полирезистентные госпитальные штаммы, Sergey Kireev, Sergey Shashkovskiy, Tatiana Grenkova, Yakov Goldshtein, Igor Goncharenko, Evgeniya Selkova, Evaluation of pulsed xenon ultraviolet irradiation of continuous spectrum for efficacy against multidrug-resistant nosocomial strains, 22 World Congress & Exhibition, Ozone and Advanced Oxidation Leading-edge science and technologies, 2015 г.
Читайте также по теме: Вирулицидная активность импульсного ультрафиолетового излучения сплошного спектра в отношении коронавируса SARS-CoV‑2 А.